题目内容
10.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 7.8g苯中碳碳双键的数目为0.3NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的个数为NA | |
| C. | 常温常压,11.2L NO和O2混合气体的原子数为NA | |
| D. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数为0.46NA |
分析 A、苯不是单双键交替的结构;
B、根据电荷守恒来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、铜只能与浓硫酸反应,与稀硫酸不反应.
解答 解:A、苯不是单双键交替的结构,故苯中不含碳碳双键,故A错误;
B、根据电荷守恒可知:n(CH3COO-)+n(OH-)=n(Na+)+n(H+),而溶液显中性,故有n(OH-)=n(H+),故有n(CH3COO-)=n(Na+),故醋酸根的个数为NA个,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L混合气体的物质的量小于0.5mol,而NO和氧气均为双原子分子,则含有的原子个数小于NA个,故C错误;
D、铜只能与浓硫酸反应,与稀硫酸不反应,故浓硫酸不能完全反应,故生成的二氧化硫分子的个数小于0.46NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
20.下列反应中,属于氧化还原反应的是( )
| A. | CaCO3+2HCl═CaCl2+CO2↑+H2O | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
1.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 医学上,血液透析是利用了胶体的渗析原理 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 二氧化硅是人类将太阳能转换为电能的常用材料 |
18.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应水化物的酸性比W的弱 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | W的气态简单氢化物的热稳定性比Y的强 |
15.下列对有关实验操作产生的影响及原因分析都正确的是( )
| 选项 | 实验目的和操作 | 影响结果 | 原因分析 |
| A | 将2g I2加入到98mLCCl4中溶解混匀后,配制质量分数为2% I2的CCl4溶液 | 偏小 | CCl4的密度大于1g•mL-1 |
| B | 用10mL的量筒测量酯化反应得到乙酸乙酯的体积,俯视液面读出数据为6.0mL | 偏小 | 平视读取应大于6.0mL |
| C | 配制2mol•L-1NaCl溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余的水 |
| D | 用尖嘴有气泡的碱式滴定管盛标准NaOH溶液滴定20.00mL某待测HCl溶液的浓度 | 偏大 | 流出碱液的量 变大 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,22.4 LSO3含有的原子数为4NA |
19.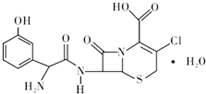 头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
 头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主要用于上、下呼吸道感染、中耳炎、皮肤、尿道感染等症状,其结构如图所示,下列关于头孢克洛的说法错误的是( )| A. | 其分子式可以表示为C15H16ClN3O6S | |
| B. | 该物质具有两性 | |
| C. | 1 mol该化合物与NaOH溶液作用时消耗NaOH的物质的量最多为 4 mol | |
| D. | 该物质遇FeCl3溶液显紫色 |
