��Ŀ����
14����ˮ���̲��ŷḻ����Դ����ˮ�ۺ����õ�����ͼ���£�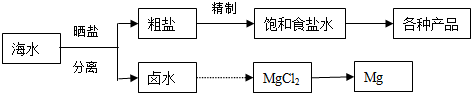
��ش��������⣺
��1����NaCl��ԭ�Ͽ��Եõ����ֲ�Ʒ��
�ٹ�ҵ����NaCl�Ʊ������ƵĻ�ѧ����ʽ��2NaCl�����ڣ� $\frac{\underline{\;ͨ��\;}}{\;}$2Na+Cl2����
��ʵ�����ö��Ե缫���100mL NaCl��Һ���������������õ�112mL���壨��״��������������Һ��pHΪ13�����Է�Ӧǰ����Һ������仯����
�۵���Ȼ���ϡ��Һ���Ʊ���84������Һ��ͨ��ʱ��������Һ��ȫ���գ�����������Һ����һ�����ʣ�д����Ӧ�Ļ�ѧ����ʽNaCl+H2O$\frac{\underline{\;ͨ��\;}}{\;}$ NaClO+H2����
��2����������κ��±ˮ���̺��ŷḻ��þ��Դ����ת����ɻ��MgCl2�ֲ�Ʒ����±ˮ����ȡþ�IJ���Ϊ��
a�������ߴ������ڵı������ճ�ʯ�ң�����ʯ���Ƴ�ʯ���飻
b����ʯ������뵽��ˮ�������о����˵õ�Mg��OH��2������
c����Mg��OH��2�����м�������õ�MgCl2��Һ���پ������ᾧ�õ�MgCl2•6H2O��
d����MgCl2•6H2O��һ�������¼��ȵõ���ˮMgCl2��
e��������ڵ��Ȼ�þ�ɵõ�Mg��
�ٲ���d�еġ�һ��������ָ�����Ȼ��������У�Ŀ��������Mg2+ˮ�⣮
��������ȡþ�������У�Ϊ�˽��ͳɱ���������Ⱦ�����Բ�ȡ�ܶ��ʩ����д������һ��e����������Cl2������ȡHCl���壬����HCl����d����MgCl2ˮ�⣬���Ƶ�c�������������ᣮ
����ͬѧ��Ϊ������b��ɼ���Mg��OH��2�õ�MgO���ٵ�����ڵ�MgO�ƽ���þ�������ɼ�ʵ�鲽�裬����ʵ��ļ�Լ��ԭ����ͬ���ͬѧ���뷨�𣿲�ͬ�⣬��˵����ͬ���ͬ���������ΪMgO�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ���
���� ��1���ٻ��ý�������ȡһ���ȡ��������εķ�����
���ɵ�ⷽ��ʽ�ɼ������������Ũ�ȣ��������PH��
�۸��������Ϣд����Ӧ����������ƽ���õ�ⷽ��ʽ��
��2���ٿ���þ���ӵ�ˮ�⣬һ�������Ƿ�ֹˮ��ķ�����
�ڰ�Ҫ�ͳɱ��ͼ�����Ⱦ�������������ÿɴﵽĿ�ģ�
�۴�����þ���۵㿼�ǣ�����þ�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ���
��� �⣺��1�������ƱȽϻ��ã���ȡʱֻ�ܲ��õ��ķ���������ʽΪ��2NaCl�����ڣ�$\frac{\underline{\;ͨ��\;}}{\;}$2Na+Cl2����
�ʴ�Ϊ��2NaCl�����ڣ� $\frac{\underline{\;ͨ��\;}}{\;}$2Na+Cl2����
�ڵ�ⱥ��ʳ��ˮ�������õ������������õ����������������ʵ���Ϊ��$\frac{0.112L}{22.4L/mol}$=0.005mol��
��2NaCl+2H2O $\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2NaOH ��֪��Cl2����H2����2NaOH����n��NaOH��=2n��Cl2��=2��0.005mol=0.01mol��c��NaOH��=$\frac{0.01mol}{0.1L}$=0.1mol/L������pH=13��
�ʴ�Ϊ��13��
�ۡ�84������ҺΪ����������Һ������Ȼ�����Һ��ȡ�������Ƶķ���ʽΪ��NaCl+H2O $\frac{\underline{\;ͨ��\;}}{\;}$NaClO+H2����
�ʴ�Ϊ��NaCl+H2O $\frac{\underline{\;ͨ��\;}}{\;}$NaClO+H2����
��2����MgCl2•6H2O��һ�������¼��ȵõ���ˮMgCl2����ֱ�Ӽ���MgCl2•6H2O����ٽ�Mg2+ˮ�⣬�ò�����ˮMgCl2����Mg2+ˮ������ԣ�����������Ȼ��������п�����Mg2+ˮ�⣬��һ������Ϊ��HCl�����У�Ŀ��������Mg2+ˮ�⣬
�ʴ�Ϊ���Ȼ��������У�����Mg2+ˮ�⣻
�ڵ�������Ȼ�þ�õ��������ж������ŷŴ����л���Ⱦ���������ѵ��õ����������������ϵõ��Ȼ��⣬���Ƶ�c����Ҫ�����ᣬ�����Ȼ�������������
Mg2+ˮ�⣬�������˳ɱ����ַ�ֹ����Ⱦ��
�ʴ�Ϊ��e����������Cl2������ȡHCl���壬����HCl����d����MgCl2ˮ�⣬���Ƶ�c�������������
������þ�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ����ʲ�ͬ���ͬѧ���뷨��
�ʴ�Ϊ����ͬ�⣬��ΪMgO�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ���
���� ���⿼���˴Ӻ�ˮ�л�ȡ��ѧ��Դ�����⣮�ڼ���PHʱ���ɸ��ݷ���ʽ���ϵʽ���м��㣬�ش�һ��������Ҫ��MgCl2�������֣��شͳɱ���Ҫ��ѭ�����á����ת���ʵȽǶȿ��ǣ���Ŀ�Ѷ��еȣ�

| A�� | ��һ�����ܣ�P��S | B�� | ��̬�⻯����ȶ��ԣ�CH4��NH3 | ||
| C�� | �縺�ԣ�CI��F | D�� | ��������ϼۣ�F��S |
| A�� | �ڳ��³�ѹ�£�11.2 ���������еķ�����Ϊ0.5NA | |
| B�� | 1 molFe��������Cl2��Ӧת�Ƶĵ�����Ϊ2NA | |
| C�� | ���³�ѹ�£�32 g O2��O3�Ļ����������ԭ����Ϊ2NA | |
| D�� | ��״���£�22.4 LSO3���е�ԭ����Ϊ4NA |
| A�� | 1 mol FeI2������������Ӧʱת�Ƶĵ�����Ϊ2NA | |
| B�� | ��ϩ�ͻ�������ɵ�42g�����������ԭ�ӵĸ���Ϊ6NA | |
| C�� | 2 L 0.5 mol•L-1�������Һ�����������������ΪNA | |
| D�� | 1 mol Na2O2�����к���������Ϊ4NA |
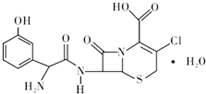 ͷ�߿������˹��ϳɵĵڶ����ڷ�ͷ�߾������أ���Ҫ�����ϡ��º�������Ⱦ���ж��ס�Ƥ���������Ⱦ��֢״����ṹ��ͼ��ʾ�����й���ͷ�߿����˵��������ǣ�������
ͷ�߿������˹��ϳɵĵڶ����ڷ�ͷ�߾������أ���Ҫ�����ϡ��º�������Ⱦ���ж��ס�Ƥ���������Ⱦ��֢״����ṹ��ͼ��ʾ�����й���ͷ�߿����˵��������ǣ�������| A�� | �����ʽ���Ա�ʾΪC15H16ClN3O6S | |
| B�� | �����ʾ������� | |
| C�� | 1 mol�û�������NaOH��Һ����ʱ����NaOH�����ʵ������Ϊ 4 mol | |
| D�� | ��������FeCl3��Һ����ɫ |
| A�� | �ʱ���ر䶼�뷴Ӧ���Է����йأ��ֶ����ܶ�������Ϊ�Է��Ե��о� | |
| B�� | -10���Һ̬ˮ�ͻ��Զ������Ϊ��̬����Ϊ���������Ĺ��� | |
| C�� | ������ʵ�������ǣ����̵��Է���ֻ�������жϹ��̵ķ�����ȷ�������Ƿ�һ���ᷢ�����̷��������� | |
| D�� | ���ȷ�Ӧ��������ϵ�������ͣ�������Է����е���������Щ���ȷ�ӦҲ�����Է����� |
��1����K2Cr2O7�ڼ��������¿�������Ũ��������������仹ԭ����ΪCr3+���÷�Ӧ�����ӷ���ʽΪCr2O72-+14H++6Cl-$\frac{\underline{\;\;��\;\;}}{\;}$2Cr3++3Cl2��+7H2O��
�ڳ����£�Fe2+�ɽ�Cr2O72-��ԭΪCr3+�����ô˷�Ӧԭ���ɴ�����ˮ���ж���Cr2O72-��ij��ˮ��Cr2O72-��Ũ��Ϊ0.005 mol/L��������10 L�÷�ˮ������Ҫ�̷���FeSO4•7H2O��83.4g��
��2��K2Cr2O7��Һ�д�������ƽ�⣺Cr2O72-����ɫ��+H2O?2CrO42-����ɫ��+2H+��
����ƽ����ϵ��pH=2������Һ�Գ�ɫ��
�ڸ���ʱ����Na2Cr2O7��Һ���ȼ������������ᣬ�ټ���һ����KCl���壬���£��ͻ�����K2Cr2O7�����NaCl����Ļ����������������ԭ��ΪH2SO4���������H+ʹCr2O72-+H2O?2CrO42-+2H+�����ƶ����Ӷ�������c��Cr2O72-�������K2Cr2O7���ʣ���ͬ�¶��£�������ʵ��ܽ���������±���ʾ�����������KCl������»�����K2Cr2O7�����ԭ��ΪK2Cr2O7���ܽ�����¶Ƚ��ͼ�С�ķ��ȴ�ʹ�ø��ֽⷴӦNa2Cr2O7+KCl=K2Cr2O7��+NaCl���Է������Ӷ�����K2Cr2O7���壮
 | 20�� | 60�� | 100�� |
| Na2Cr2O7 | 73.2 | 82.0 | 91.4 |
| K2Cr2O7 | 13.1 | 50.5 | 96.2 |
| NaCl | 36 | 37 | 39 |
| KCl | 34 | 45.5 | 56.7 |
| A�� | ���õ�ⱥ��MgCl2��Һ�ķ�����ý���þ | |
| B�� | ��ⷨ������ͭ���ô�ͭ����������ͭ������ | |
| C�� | �������Al2O3�Ʊ�������ʱ���������ʯʹAl2O3�����ۻ� | |
| D�� | �ȼҵ�е��ʳ��ˮʱ�������ӽ���Ĥ�ɷ�ֹ������NaOH��Һ��Ӧ |