题目内容
12.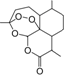 我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )
我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H20O5 | B. | 易溶于C2H5OC2H5 | ||
| C. | 官能团有醚键和酯基 | D. | 能与NaOH溶液反应 |
分析 A.根据结构简式确定分子式;
B.该物质中不含亲水基,只含憎水基;
C.该物质中含有酯基、醚键和过氧键;
D.酯基能发生水解反应.
解答 解:A.根据结构简式知,分子式为C15H22O5,故A错误;
B.该物质中不含亲水基,只含憎水基,根据相似相溶原理知,该物质易溶于有机溶剂而不易溶于水,故B正确;
C.该物质中含有酯基、醚键和过氧键,故C正确;
D.酯在碱性溶液中可以发生水解反应,故D正确;
故选A.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酯、相似相溶原理等知识点,题目难度不大.

练习册系列答案
相关题目
2.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,22.4 LSO3含有的原子数为4NA |
3.重铬酸钾(K2Cr2O7)是一种重要的无机试剂.
(1)①K2Cr2O7在加热条件下可以氧化浓盐酸产生氯气,其还原产物为Cr3+.该反应的离子方程式为Cr2O72-+14H++6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
②常温下,Fe2+可将Cr2O72-还原为Cr3+,利用此反应原理可处理废水中有毒的Cr2O72-.某废水中Cr2O72-的浓度为0.005 mol/L,若处理10 L该废水至少需要绿矾(FeSO4•7H2O)83.4g.
(2)K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.
①若平衡体系的pH=2,则溶液显橙色.
②高温时,向饱和Na2Cr2O7溶液中先加入少量的硫酸,再加入一定量KCl固体,降温,就会析出K2Cr2O7晶体和NaCl晶体的混合物.加入少量硫酸的原因为H2SO4电离产生的H+使Cr2O72-+H2O?2CrO42-+2H+逆向移动,从而增大了c(Cr2O72-),提高K2Cr2O7产率;不同温度下,相关物质的溶解度数据如下表所示,请分析加入KCl固体后,降温会析出K2Cr2O7晶体的原因为K2Cr2O7的溶解度随温度降低减小的幅度大,使得复分解反应Na2Cr2O7+KCl=K2Cr2O7↓+NaCl得以发生,从而析出K2Cr2O7晶体.
③向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2,可析出BaCrO4和PbCrO4两种沉淀,此时溶液中$\frac{c(P{b}^{2+})}{c(B{a}^{2+})}$=2.3×10-3.[已知:Ksp(BaCrO4)=1.2×10-10;Ksp(PbCrO4)=2.8×10-13].
(1)①K2Cr2O7在加热条件下可以氧化浓盐酸产生氯气,其还原产物为Cr3+.该反应的离子方程式为Cr2O72-+14H++6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
②常温下,Fe2+可将Cr2O72-还原为Cr3+,利用此反应原理可处理废水中有毒的Cr2O72-.某废水中Cr2O72-的浓度为0.005 mol/L,若处理10 L该废水至少需要绿矾(FeSO4•7H2O)83.4g.
(2)K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.
①若平衡体系的pH=2,则溶液显橙色.
②高温时,向饱和Na2Cr2O7溶液中先加入少量的硫酸,再加入一定量KCl固体,降温,就会析出K2Cr2O7晶体和NaCl晶体的混合物.加入少量硫酸的原因为H2SO4电离产生的H+使Cr2O72-+H2O?2CrO42-+2H+逆向移动,从而增大了c(Cr2O72-),提高K2Cr2O7产率;不同温度下,相关物质的溶解度数据如下表所示,请分析加入KCl固体后,降温会析出K2Cr2O7晶体的原因为K2Cr2O7的溶解度随温度降低减小的幅度大,使得复分解反应Na2Cr2O7+KCl=K2Cr2O7↓+NaCl得以发生,从而析出K2Cr2O7晶体.
 | 20℃ | 60℃ | 100℃ |
| Na2Cr2O7 | 73.2 | 82.0 | 91.4 |
| K2Cr2O7 | 13.1 | 50.5 | 96.2 |
| NaCl | 36 | 37 | 39 |
| KCl | 34 | 45.5 | 56.7 |
7.有化合物X、Y、Z、W,其焰色反应均为紫色.它们按下列反应式转化:
①X+Ca(OH)2→Y+CaCO3↓
②W$\stackrel{△}{→}$X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X、Y、Z、W依次是( )
①X+Ca(OH)2→Y+CaCO3↓
②W$\stackrel{△}{→}$X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X、Y、Z、W依次是( )
| A. | KCl、KOH、K2CO3、KHCO3 | B. | K2CO3、KOH、K2O2、KHCO3 | ||
| C. | K2SO3、KOH、K2O2、KHCO3 | D. | KHCO3、KOH、K2O2、K2CO3 |
17.下列有关绿色化学的叙述中,不正确的是( )
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| C. | 绿色化学反应选择的原料、催化剂、溶剂都应该是无毒无害的 | |
| D. | 乙烯分别与溴水和溴的四氯化碳溶液反应制备1,2-二溴乙烷的原子利用率均为100% |
4.下列描述中,不符合生产实际的是( )
| A. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| B. | 电解法精炼粗铜,用粗铜作阳极,纯铜作阴极 | |
| C. | 电解熔融Al2O3制备金属铝时,加入冰晶石使Al2O3更易熔化 | |
| D. | 氯碱工业中电解食盐水时,阳离子交换膜可防止氯气与NaOH溶液反应 |

 .
.
 _.
_.