题目内容
1.(多项选择题)目前下列工艺过程使用了离子交换技术的是( )| A. | 精炼铜 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 海水淡化 | D. | 海水中提取非金属Br2 |
分析 使用离子交换技术改变溶液中离子浓度,不会得到金属单质,以此来解答.
解答 解:A.精炼铜时,粗铜用阳极,纯铜为阴极,电解质为铜盐溶液,无需用到离子交换,故A不选;
B.电解饱和食盐水制造NaOH,使用离子交换技术利用钠-氢交换、氯-氢氧根交换,故B选;
C.淡化海水常用电渗析法,使用离子交换膜对离子的选择性透过,故C选;
D.海水中提取非金属Br2用氯气置换,可用空气吹出,以达到富集的目的,与离子交换无关,故D不选.
故选BC.
点评 本题考查混合物分离提纯及海水资源的综合应用,为高频考点,把握离子交换技术的原理及应用为解答的关键,题目难度中等.

练习册系列答案
相关题目
1.将CH4和CO2两种最主要的温室气体重整也能获得CO和H2混合气.该反应中相关的化学键键能数据如下:
(1)写出CH4和CO2重整获得CO和H2的热化学方程式:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=246kJ/mol.消耗1mol CO2时,转移电子的物质的量是6mol.
(2)CH4和CO2重整反应过程复杂,还会发生的反应有:
2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol
CH4(g)═C(s)+2H2 (g)△H2
结合(1)中所给数据可得△H2=-74kJ/mol.
| 化学键 | H-H | C=O | C═O | C-H |
| E/(kJ•mol-1) | 436 | 803 | 1070 | 413 |
(2)CH4和CO2重整反应过程复杂,还会发生的反应有:
2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol
CH4(g)═C(s)+2H2 (g)△H2
结合(1)中所给数据可得△H2=-74kJ/mol.
2.化学与环境保护、工业生产、生活等密切相关,下列说法不正确的是( )
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | pM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 神舟10号飞船所用太阳能电池板的材料是单晶硅 |
19.下列说法正确的是( )
| A. | 在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石);△H=+119kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3l kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与l mol NaOH溶液混合,放出的热量大于57.31 kJ |
10.CO是高炉炼铁的主要反应物之一,发生的主要反应为$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<0(填“>”、“<”或“=”).
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
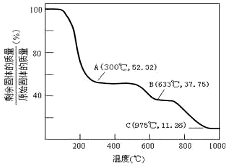
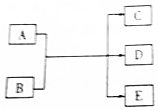 一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体. ,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
 .
.