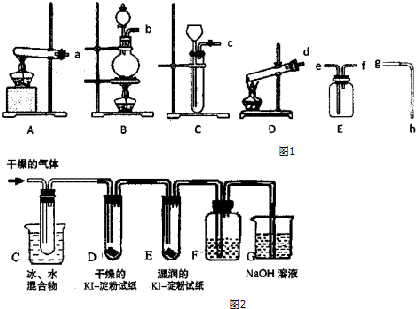
题目内容
6.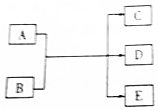 一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.(1)x为第3周期原子半径最小的元素,y为第3周期原子半径最大的元素,若A、C、D均含x元素,B、C、D均含y元素,D的溶液具有漂白性,则B的电子式为
 ,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.(2)z、w为短周期相邻元素,w原子的最外层电子数是内层电子数的两倍,则w在元素周期表中的位置为第二周期ⅣA族.若A为元素w的单质,B为z的最高价氧化物对应水化物,则A与B的浓溶液反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
分析 (1)x为第3周期原子半径最小的元素,则x为Cl元素;y为第3周期原子半径最大的元素,则y为Na元素;若A、C、D均含x(Cl)元素,A为单质,则A为氯气;B、C、D均含y(Na)元素,D的溶液具有漂白性,则D为NaClO,再根据“B为化合物,常温下E为无色液体”可知B为NaOH、E为水,据此进行解答;
(2)z、w为短周期相邻元素,w原子的最外层电子数是内层电子数的两倍,则w还有2个电子层,最外层含有4个电子,为C元素,x为B或N元素;若A为元素w的单质,则A为单质碳;B为z的最高价氧化物对应水化物,则B为强酸,x只能为N元素,故B为浓硝酸,据此进行解答.
解答 解:(1)x为第3周期原子半径最小的元素,则x为Cl元素;y为第3周期原子半径最大的元素,则y为Na元素;若A、C、D均含x(Cl)元素,A为单质,则A为氯气;B、C、D均含y(Na)元素,D的溶液具有漂白性,则D为NaClO,再根据“B为化合物,常温下E为无色液体”可知B为NaOH、E为H2O,
B为氢氧化钠,属于离子化合物,其电子式为 ,氢氧化钠中含有离子键和共价键;
,氢氧化钠中含有离子键和共价键;
氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应为:Cl2+2NaOH=NaCl+NaClO+H2O;
D为次氯酸钠,次氯酸钠具有强氧化性,I-具有强还原性,二者发生氧化还原反应生成I2,反应的离子方程式为:2H++2I-+ClO-=Cl-+H2O+I2,
故答案为: ;离子键、共价键;Cl2+2NaOH=NaCl+NaClO+H2O;2H++2I-+ClO-=Cl-+H2O+I2;
;离子键、共价键;Cl2+2NaOH=NaCl+NaClO+H2O;2H++2I-+ClO-=Cl-+H2O+I2;
(2)z、w为短周期相邻元素,w原子的最外层电子数是内层电子数的两倍,则w还有2个电子层,最外层含有4个电子,为C元素,x为B或N元素;若A为元素w的单质,则A为单质碳;B为z的最高价氧化物对应水化物,则B为强酸,x只能为N元素,故B为浓硝酸,
w为C元素,原子序数为6,位于周期表中第二周期ⅣA族;
A为碳单质,B为浓硝酸,碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水,反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:第二周期ⅣA族;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
点评 本题考查无机推断,题目难度中等,明确常见元素及其化合物性质为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重考查学生的分析、理解能力及逻辑推理能力.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
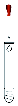 1.0mL | 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5mol•L-1NaOH溶液:再滴加1.5mL1.0mol•L-1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
| 0.1mol•L-1AlCl3溶液 | Ⅱ.加碱时出现白色沉淀,又逐渐溶解直至消失;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
| 0.1mol•L-1Fe(NO3)2溶液 | Ⅲ.加碱时生成白色沉淀迅速变成灰绿色,最后变成红褐色;加酸后溶液变为黄色 | ||
| 新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
(2)II中加碱时出现的现象是出现白色沉淀,又逐渐溶解直至消失,此现象说明溶液中发生反应的离子方程式是Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(3)III中加碱时出现的现象是生成白色沉淀迅速变成灰绿色,最后变成红褐色.
(4)用离子方程式解释IV中加碱时出现的现象:Cl2+2OH-═ClO-+Cl-+H2O.
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验.
| 实验 | 试剂及操作 | 现象 | |
| 试管 | 滴管 | ||
 1.0 mL | 0.1 mol•L-1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol•L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol•L-1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
向1.0mL 0.1mol•L-1Fe(NO3)2溶液中滴加KSCN溶液,没有明显现象,再向其中滴加1.5mL1.0mol•L-1H2SO4溶液,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应.
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1mol•L-1 Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b.4Fe2++O2+4H+═4Fe3++2H2O(用离子方程式表示).
| A. | 燃料的脱硫脱氮、NO的催化转化都是减少酸雨产生的措施 | |
| B. | 利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性 | |
| C. | BaSO4难溶于水和强酸,在医学上常用作钡餐 | |
| D. | 食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 |
| A. | 硫酸酸与氢氧化钡反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 过量CO2通入NaOH溶液中 CO2+OH-=H CO3- | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 锌与稀硝酸反应 Zn+2H+═Zn2++H2↑ |
| A. | 精炼铜 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 海水淡化 | D. | 海水中提取非金属Br2 |
| A. | CO、H2S的转化率之比为1:1 | |
| B. | 达平衡后H2S的体积分数为29.4% | |
| C. | 升高温度,COS浓度减小,表明该反应是吸热反应 | |
| D. | 恒温下向平衡体系中再加入CO、H2S、COS、H2各1 mol,平衡不移动 |

已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3=[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种)增大硫酸浓度或升高温度或边加硫酸边搅拦或增加浸出时间等.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计(或者酸度计或试纸).
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(5)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C.
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值.