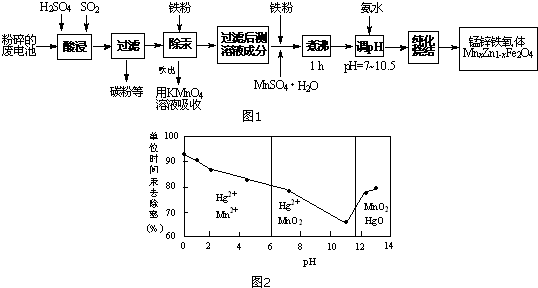
题目内容
11.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥 HCl 气体反应制得 SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2;
③SiHCl3与过量 H2在1 000~1 100℃反应制得纯硅.已知 SiHCl3能与 H2O 强烈反应,在空气中易自燃.
请回答下列问题:
(1)第①步制备粗硅的化学方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)粗硅与 HCl 反应完全后,经冷凝得到的 SiHCl3(沸点33.0℃)中含有少量 SiCl4(沸点 57.6℃)和 HCl(沸点-84.7℃),提纯 SiHCl3采用的方法为分馏.
(3)用 SiHCl3与过量 H2反应制备纯硅的装置如图(热源及夹持装置略去):
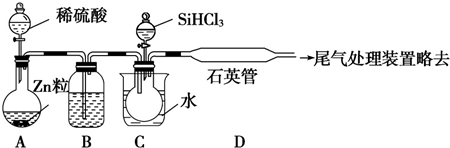
①装置B中的试剂是浓硫酸.装置C中的烧瓶需要加热,其目的是使滴入烧瓶中的SiHCl3气化.
②装置D中发生反应的化学方程式为SiHCl3+H2 $\frac{\underline{\;1000-1100℃\;}}{\;}$Si+3HCl.
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及通一段时间H2,将装置中的空气排尽;. ④SiHCl3遇水剧烈反应生成 H2SiO3、HCl 和另一种物质,写出配平的化学方程式SiHCl3+3H2O═H2SiO3+H2↑+3HCl.
分析 (1)高温下用碳还原二氧化硅制得粗硅和一氧化碳;
(2)粗硅与干燥 HCl 气体反应制得 SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2;SiHCl3与过量 H2在1 000~1 100℃反应制得纯硅.已知 SiHCl3能与 H2O 强烈反应,在空气中易自燃,高温下,碳和二氧化硅反应生成硅和一氧化碳;根据题中数据,采用分馏方法提纯SiHCl3;
(3)①生成的氢气含有水蒸气,用浓H2SO4干燥;加热促使SiHCl3气化;
②SiHCl3和氢气反应有硅单质生成,根据硅的颜色判断D装置中的颜色变化;反应温度较高,普通玻璃会软化;SiHCl3和H2反应生成硅和氯化氢;
③氢气属于易燃气体,和氧气混合在加热条件下易产生爆炸;
④SiHCl3易和水发生水解反应.
解答 解:(1)高温下,碳和二氧化硅反应生成硅和一氧化碳,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),由于沸点差别较大,可以通过分馏除去杂质,
故答案为:分馏;
(3)①锌和稀硫酸的反应是放热反应,所以生成的氢气含有水蒸气,为干燥氢气,一般选用浓H2SO4干燥;气体的反应速率较大,所以加热的目的是使SiHCl3气化,
故答案为:浓硫酸;使滴入烧瓶中的SiHCl3气化;
②高温下,SiHCl3和氢气反应生成硅单质,硅单质是灰黑色固体,所以D装置中的现象是:石英管的内壁附有灰黑色晶体;反应方程式为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,
故答案为:SiHCl3+H2$\frac{\underline{\;1000-1100℃\;}}{\;}$Si+3HCl;
③氢气属于易燃气体,和氧气混合在加热条件下易产生爆炸,所以实验开始前应该通一段时间H2,为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气.故答案为:通一段时间H2,将装置中的空气排尽;
④SiHCl3易和水发生水解反应,SiHCl3遇水剧烈反应生成 H2SiO3、HCl 和另一种物质,依据电子守恒和原子守恒得到发生反应的化学方程式为:为SiHCl3+3H2O═H2SiO3+H2↑+3HCl;
故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl.
点评 本题考查了实验方案设计的有关知识,铁离子和亚铁离子的检验在高考题中出现,这种类型的题是高考的热点,是学习的重点,会根据实验目的和物质的性质选取实验装置和实验药品,然后进行相应的实验,题目难度中等.

| A. | 精炼铜 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 海水淡化 | D. | 海水中提取非金属Br2 |
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: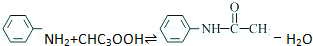
实验参数:
| 名称 | 性状 | 密度/(g/cm3) | 沸点/℃ | 溶解性 |
| 苯胺 | 无色油状液体,有还原性 | 1.02 | 184.4 | 微溶于水 易溶于乙醇、乙醚等 |
| 乙酸 | 无色液体 | 1.05 | 118.1 | 易溶于水 易溶于乙醇、乙醚 |
| 酰苯胺 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.3mL,冰醋酸18.4mL,锌粉0.1g,安装仪器,加入沸石,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出.
步骤2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品.
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率.
请回答下列问题:
(1)步骤1中所选圆底烧瓶的最佳规格是b.
a.25mL b.50mL c.150mL d.200mL
(2)从化学平衡的角度分析,要控制分馏柱上端的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)步骤1加热可用油浴(填“水浴”或“油浴”).
(4)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(5)步骤2得到的粗晶体中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗晶体用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(6)该实验最终得到纯品9.1g,已知苯胺、乙酸和乙酰苯胺的摩尔质量分别为93g•mol-1、60g•mol-1、135g•mol-1.则乙酰苯胺的产率是66%.
( )
| A. | 36 | B. | 30 | C. | 25 | D. | 20 |
| A. | 碳酸铵在室温下能自发发生分解,是由于反应生成了易挥发的气体,使体系的熵增大 | |
| B. | 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 | |
| C. | 与外界隔离的体系,自发过程将导致体系的熵减小 | |
| D. | 在一定条件下,非自发进行的反应也能够发生 |
| A. | 钠和铁都是具有多种化合价金属,所同条件下与氧气反应时能得到不同的产物 | |
| B. | 将钠暴露在空气中,表面形成较为疏松的氧化膜,不能阻止其被继续氧化 | |
| C. | 钠元素的化学性质活泼,主要表现为具有还原性 | |
| D. | 金属铝的化学性质稳定,可以用来做日常用的铝制品 |
| A. | 工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质 | |
| B. | Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐 | |
| C. | 二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应 | |
| D. | 氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |