题目内容
19.下列说法正确的是( )| A. | 在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石);△H=+119kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3l kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与l mol NaOH溶液混合,放出的热量大于57.31 kJ |
分析 A、硫蒸气变化为硫固体放热,据此判断;
B、物质能量越高越活泼;
C、2g H2物质的量为1mol,生成液态水放出285.8 kJ 热量,依据热化学方程式书写方法分析;
D、依据浓硫酸溶解过程中放热分析.
解答 解:A、硫蒸气变化为硫固体放热,在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故A错误;
B、物质能量越高越活泼,由“C(石墨)=C(金刚石);△H=+119kJ•mol-1”可知反应是吸热反应,金刚石能量高,金刚石比石墨活泼,故B错误;
C、2g H2物质的量为1mol,生成液态水放出285.8 kJ 热量,反应焓变为负值,故C错误;
D、依据浓硫酸溶解过程中放热分析,在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3l kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.31 kJ,故D正确;
故选D.
点评 本题考查了化学反应能量变化分析,反应焓变意义理解应用,热化学方程式书写,掌握基础是关键,题目较简单.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
9.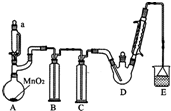 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
(1)仪器A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为冷凝回流,写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%(计算结果保留三位有效数字).
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是abc.
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为冷凝回流,写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%(计算结果保留三位有效数字).
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是abc.
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.
7.下列叙述不正确的是( )
| A. | 1molCH4与4molCl2在光照下完全反应可生成1molCCl4 | |
| B. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| C. | 乙烯能被酸性高锰酸钾溶液氧化,而苯不易 | |
| D. | 1体积的C2H4完全燃烧需同温同压下3体积的O2 |
14.化学与生活密切相关.下列有关说法不正确的是( )
| A. | 燃料的脱硫脱氮、NO的催化转化都是减少酸雨产生的措施 | |
| B. | 利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性 | |
| C. | BaSO4难溶于水和强酸,在医学上常用作钡餐 | |
| D. | 食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 |
1.(多项选择题)目前下列工艺过程使用了离子交换技术的是( )
| A. | 精炼铜 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 海水淡化 | D. | 海水中提取非金属Br2 |
19. 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
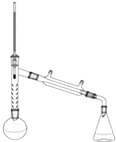
实验参数:
实验装置:(见图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.3mL,冰醋酸18.4mL,锌粉0.1g,安装仪器,加入沸石,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出.
步骤2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品.
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率.
请回答下列问题:
(1)步骤1中所选圆底烧瓶的最佳规格是b.
a.25mL b.50mL c.150mL d.200mL
(2)从化学平衡的角度分析,要控制分馏柱上端的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)步骤1加热可用油浴(填“水浴”或“油浴”).
(4)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(5)步骤2得到的粗晶体中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗晶体用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(6)该实验最终得到纯品9.1g,已知苯胺、乙酸和乙酰苯胺的摩尔质量分别为93g•mol-1、60g•mol-1、135g•mol-1.则乙酰苯胺的产率是66%.
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: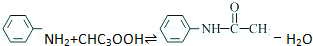
实验参数:
| 名称 | 性状 | 密度/(g/cm3) | 沸点/℃ | 溶解性 |
| 苯胺 | 无色油状液体,有还原性 | 1.02 | 184.4 | 微溶于水 易溶于乙醇、乙醚等 |
| 乙酸 | 无色液体 | 1.05 | 118.1 | 易溶于水 易溶于乙醇、乙醚 |
| 酰苯胺 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.3mL,冰醋酸18.4mL,锌粉0.1g,安装仪器,加入沸石,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出.
步骤2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品.
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率.
请回答下列问题:
(1)步骤1中所选圆底烧瓶的最佳规格是b.
a.25mL b.50mL c.150mL d.200mL
(2)从化学平衡的角度分析,要控制分馏柱上端的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)步骤1加热可用油浴(填“水浴”或“油浴”).
(4)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(5)步骤2得到的粗晶体中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗晶体用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(6)该实验最终得到纯品9.1g,已知苯胺、乙酸和乙酰苯胺的摩尔质量分别为93g•mol-1、60g•mol-1、135g•mol-1.则乙酰苯胺的产率是66%.