题目内容
6.某研究小组利用含少量Fe2+的硫酸铵酸性废液制取铵明矾[NH4Al(SO4)2•12H2O]的流程如下: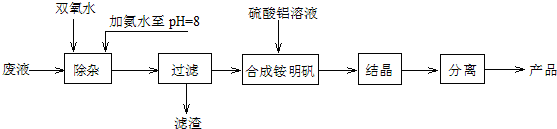
(1)H2O2的电子式为
 .
.(2)滤渣的主要成分为Fe(OH)3(填写化学式).
(3)“除杂”过程中加入双氧水的目的是(用离子方程式回答)2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水),母液不能蒸干的原因是防止晶体失去结晶水.
(5)固体铵明矾加热过程中,固体残留率(固体残留率=$\frac{剩余固体的质量}{原来固体的质量}$×100%)随温度的变化如图所示.
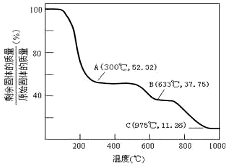
①取A物质溶于水配成溶液,加入过量NaOH溶液充分混合,加热,发生反应的离子方程式为NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O.
②B物质的化学式为Al2(SO4)3.
③若将B物质加热至975℃灼烧,得到的主要产物为C和一种氧化性气体,取等量C分别与足量的NaOH溶液和稀硫酸反应,消耗NaOH和硫酸的物质的量之比为2:3.
分析 由工艺流程可知,加入H2O2将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液pH值至8,Fe3+转化为Fe(OH)3沉淀,过滤后滤渣为Fe(OH)3,滤液主要含硫酸铵,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体;
(1)过氧化氢中H、O原子之间存在一对共用电子对,O原子之间也存在一对共用电子对;
(2)pH=8时铁离子能转化为Fe(OH)3;
(3)双氧水具有强氧化性,能氧化亚铁离子生成铁离子;
(4)NH4Al(SO4)2•12H2O不稳定,受热易失水;
(5)①NH4+、Al3+和OH-反应分别生成NH3、AlO2-、和H2O;
②如果晶体完全失去水,固体残留率=$\frac{237}{453}$×100%≈52%,则A点物质为NH4Al(SO4)2;
当温度继续升高,硫酸铝铵中的硫酸铵开始分解生成氨气和三氧化硫,硫酸铵完全分解时,剩余物为硫酸铝,剩余固体与原始固体的质量百分比是:$\frac{171}{453}$×100%≈37.75%;当比值大于37.75%时,硫酸铵没有完全分解,当等于这个比值,说明硫酸铵恰好分解完全,小于这个比值,硫酸铝开始分解;
③硫酸铝分解生成C和一种氧化性气体,C物质应该具有还原性,C能溶于强酸、强碱,结合硫酸铝中元素知,C是Al,由反应方程式计算.
解答 解:由工艺流程可知,加入H2O2将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液pH值至8,Fe3+转化为Fe(OH)3沉淀,过滤后滤渣为Fe(OH)3,滤液主要含硫酸铵,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体;
(1)过氧化氢中H、O原子之间存在一对共用电子对,O原子之间也存在一对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(2)pH=8时铁离子能转化为Fe(OH)3,所以滤渣成分为Fe(OH)3,故答案为:Fe(OH)3;
(3)双氧水具有强氧化性,能氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)NH4Al(SO4)2•12H2O不稳定,受热易失水而不能实现目的,所以不能将溶液蒸干,
故答案为:防止晶体失去结晶水;
(5)①NH4+、Al3+和OH-反应分别生成NH3、AlO2-、和H2O,离子方程式为NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O,故答案为:NH4++Al3++5OH-$\frac{\underline{\;\;△\;\;}}{\;}$AlO2-+NH3↑+3H2O;
②如果晶体完全失去水,固体残留率=$\frac{237}{453}$×100%≈52%,则A点物质为NH4Al(SO4)2;
当温度继续升高,硫酸铝铵中的硫酸铵开始分解生成氨气和三氧化硫,硫酸铵完全分解时,剩余物为硫酸铝,剩余固体与原始固体的质量百分比是:$\frac{171}{453}$×100%≈37.75%;当比值大于37.75%时,硫酸铵没有完全分解,当等于这个比值,说明硫酸铵恰好分解完全,小于这个比值,硫酸铝开始分解,根据图中数据知,固体残留物成分是Al2(SO4)3,故答案为:Al2(SO4)3;
③硫酸铝分解生成C和一种氧化性气体,C物质应该具有还原性,C能溶于强酸、强碱,结合硫酸铝中元素知,C是Al,Al和NaOH溶液、稀硫酸反应方程式分别为2Al+2NaOH+2H2O=2NaAlO2+3H2↑、
2Al+3H2SO4=Al2(SO4)3+3H2↑,根据方程式知,相同物质的量的Al分别与NaOH、硫酸反应物质的量之比=2:3,故答案为:2:3.
点评 本题考查物质制备,为高频考点,涉及元素化合物之间转化、物质分离提纯、未知物成分确定等知识点,侧重考查学生分析判断及知识综合应用能力,难点是(5)题解答,注意铵明矾受热时反应先后顺序,题目难点中等.

 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ•mol-1、-283.0kJ•mol -1和-726.5kJ•mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,5min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
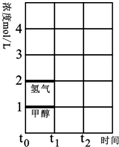
(3)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
| A. | 1molCH4与4molCl2在光照下完全反应可生成1molCCl4 | |
| B. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| C. | 乙烯能被酸性高锰酸钾溶液氧化,而苯不易 | |
| D. | 1体积的C2H4完全燃烧需同温同压下3体积的O2 |
| A. | 精炼铜 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 海水淡化 | D. | 海水中提取非金属Br2 |
①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
②3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑
⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
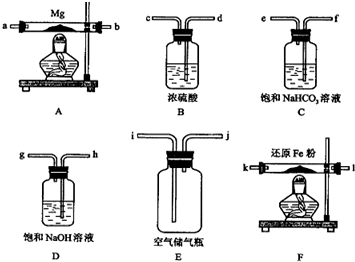
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).
回答下列问题;
在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
| 装置 | 目的 |
(3)通气后,应先点燃F处的酒精灯,再点燃A处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?制得的氮化镁不纯;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁,若试纸不变蓝,则不含有Mg3N2.
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2═CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:
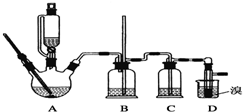
有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母);
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母);
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 碳酸铵在室温下能自发发生分解,是由于反应生成了易挥发的气体,使体系的熵增大 | |
| B. | 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 | |
| C. | 与外界隔离的体系,自发过程将导致体系的熵减小 | |
| D. | 在一定条件下,非自发进行的反应也能够发生 |