题目内容
1.将CH4和CO2两种最主要的温室气体重整也能获得CO和H2混合气.该反应中相关的化学键键能数据如下:| 化学键 | H-H | C=O | C═O | C-H |
| E/(kJ•mol-1) | 436 | 803 | 1070 | 413 |
(2)CH4和CO2重整反应过程复杂,还会发生的反应有:
2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol
CH4(g)═C(s)+2H2 (g)△H2
结合(1)中所给数据可得△H2=-74kJ/mol.
分析 (1)化学反应的焓变等于旧键断裂消耗的能量和新键生成释放能量之差;根据热化学方程式的书写方法进行回答;
(2)根据(1)的答案以及反应2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol,利用盖斯定律得到CH4(g)═C(s)+2H2 (g)△H2,计算焓变即可.
解答 解:(1)CH4和CO2重整获得CO和H2的化学方程式为:CH4(g)+CO2(g)=2CO(g)+2H2(g),其焓变△H=(413×4+2×803-2×1070-436×2)kJ/mol=246kJ/mol,所以CH4和CO2重整获得CO和H2的热化学方程式为:CH4(g)+CO2(g)=2CO(g)+2H2(g),△H=246kJ/mol,消耗1mol CO2时,转移电子的物质的量是6mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g),△H=246kJ/mol;6;
(2)①CH4(g)+CO2(g)=2CO(g)+2H2(g),△H=246kJ/mol;②2CO(g)═C(s)+CO2(g)△H1=-172kJ/mol,反应①+②得到CH4(g)═C(s)+2H2 (g)所以焓变△H2=246kJ/mol-172kJ/mol=-74kJ/mol,故答案为:-74kJ/mol.
点评 本题考查学生对热化学方程式的书写以及盖斯定律的应用知识,属于综合知识的考查,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
14.在标准状况下,ag气体A与bg气体B的分子数相同,下列说法中不正确的是( )
| A. | 同温同压下A、B两气体的密度之比为a:b | |
| B. | 同质量气体A与B的分子数之比为b:a | |
| C. | 两种气体A与B的相对分子质量之比为b:a | |
| D. | 相同状况下同体积A、B质量之比为a:b |
12.用活性炭还原法可以处理氮氧化物,T℃时,向容积为1L的密闭容器中加入0.10molNO气体和2.03mol炭粉,发生反应:C(s)+2NO(g)═N2(g)+CO2(g)△H>0.2min后反应达到平衡,测得N2为0.03mol,下列有关说法错误的是( )
| A. | 2min内,用NO表示的该反应的平均速度v(NO)=0.03mol•L-1•min-1 | |
| B. | 容器内混合气体密度保持不变可以说明反应达到平衡状态 | |
| C. | T℃时,该反应的平衡常数K=$\frac{9}{32}$ | |
| D. | 升高温度,可以提高反应速率和NO的转化率 |
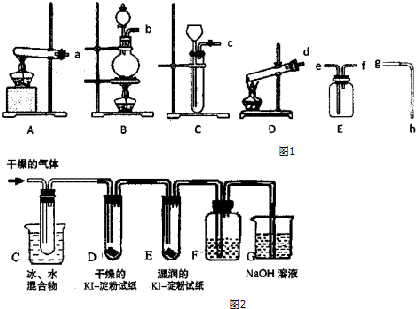
9.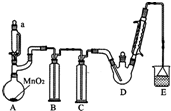 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
(1)仪器A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为冷凝回流,写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%(计算结果保留三位有效数字).
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是abc.
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是饱和食盐水,若撤去装置B,可能导致装置D中副产物C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)装置中球形冷凝管的作用为冷凝回流,写出E中所有可能发生的无机反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行不可行.
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1Na2S2O3溶液滴定至终点.进行三次平行实验,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为66.4%(计算结果保留三位有效数字).
滴定的反应原理:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑
I2+2S2O32-═2I-+S4O62-
(6)为证明三氯乙酸的酸性比乙酸强,某学习小组的同学设计了以下三种方案,你认为能够达到实验目的是abc.
a.分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小
b.用仪器测量浓度均为0.1mol•L-1的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH较大.
6. 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ•mol-1、-283.0kJ•mol -1和-726.5kJ•mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K).
①由表中数据判断△H<0 (填“>”、“=”或“<”);
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,5min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
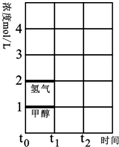
(3)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ•mol-1、-283.0kJ•mol -1和-726.5kJ•mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,5min达到平衡时测得c(CO)=0.2mol•L-1,此时的温度为250℃,则反应速率v(H2)=0.32 mol•L-1•min-1.
(3)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇).
1.(多项选择题)目前下列工艺过程使用了离子交换技术的是( )
| A. | 精炼铜 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 海水淡化 | D. | 海水中提取非金属Br2 |