题目内容
10.CO是高炉炼铁的主要反应物之一,发生的主要反应为$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
分析 化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体的浓度为常数,不需要写固体、纯液体;根据温度变化对化学平衡常数的影响分析该反应的焓变.
解答 解:反应$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)的平衡常数为:K=$\frac{c(C{O}_{2})}{c(CO)}$;
由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,其△H<0,
故答案为:$\frac{c(C{O}_{2})}{c(CO)}$;<.
点评 本题考查了化学平衡及其影响,题目难度不大,明确化学平衡常数的概念及表达式为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
1.(多项选择题)目前下列工艺过程使用了离子交换技术的是( )
| A. | 精炼铜 | B. | 电解饱和食盐水制造NaOH | ||
| C. | 海水淡化 | D. | 海水中提取非金属Br2 |
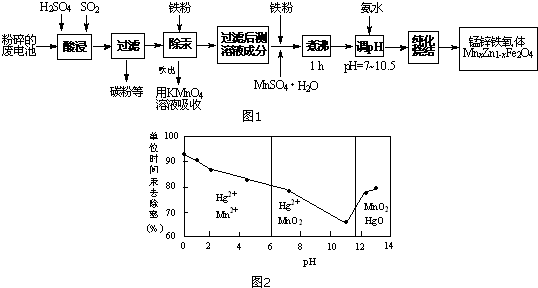
5.高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.下图是用高炉烟尘制取硫酸锌的工业流程.

已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
②过二硫酸铵是一种强氧化剂.
③ZnSO4+4NH3=[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种)增大硫酸浓度或升高温度或边加硫酸边搅拦或增加浸出时间等.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计(或者酸度计或试纸).
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(5)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C.
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值.

已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3=[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种)增大硫酸浓度或升高温度或边加硫酸边搅拦或增加浸出时间等.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计(或者酸度计或试纸).
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(5)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C.
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值.
15.实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2═CH2Br
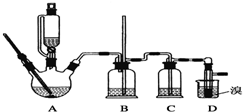
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母);
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母);
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2═CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母);
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母);
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
19. 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
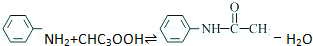
实验参数:
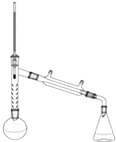
实验装置:(见图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.3mL,冰醋酸18.4mL,锌粉0.1g,安装仪器,加入沸石,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出.
步骤2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品.
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率.
请回答下列问题:
(1)步骤1中所选圆底烧瓶的最佳规格是b.
a.25mL b.50mL c.150mL d.200mL
(2)从化学平衡的角度分析,要控制分馏柱上端的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)步骤1加热可用油浴(填“水浴”或“油浴”).
(4)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(5)步骤2得到的粗晶体中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗晶体用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(6)该实验最终得到纯品9.1g,已知苯胺、乙酸和乙酰苯胺的摩尔质量分别为93g•mol-1、60g•mol-1、135g•mol-1.则乙酰苯胺的产率是66%.
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: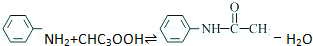
实验参数:
| 名称 | 性状 | 密度/(g/cm3) | 沸点/℃ | 溶解性 |
| 苯胺 | 无色油状液体,有还原性 | 1.02 | 184.4 | 微溶于水 易溶于乙醇、乙醚等 |
| 乙酸 | 无色液体 | 1.05 | 118.1 | 易溶于水 易溶于乙醇、乙醚 |
| 酰苯胺 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.3mL,冰醋酸18.4mL,锌粉0.1g,安装仪器,加入沸石,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出.
步骤2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品.
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率.
请回答下列问题:
(1)步骤1中所选圆底烧瓶的最佳规格是b.
a.25mL b.50mL c.150mL d.200mL
(2)从化学平衡的角度分析,要控制分馏柱上端的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)步骤1加热可用油浴(填“水浴”或“油浴”).
(4)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(5)步骤2得到的粗晶体中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗晶体用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(6)该实验最终得到纯品9.1g,已知苯胺、乙酸和乙酰苯胺的摩尔质量分别为93g•mol-1、60g•mol-1、135g•mol-1.则乙酰苯胺的产率是66%.
20.下列说法正确的是( )
| A. | 钠和铁都是具有多种化合价金属,所同条件下与氧气反应时能得到不同的产物 | |
| B. | 将钠暴露在空气中,表面形成较为疏松的氧化膜,不能阻止其被继续氧化 | |
| C. | 钠元素的化学性质活泼,主要表现为具有还原性 | |
| D. | 金属铝的化学性质稳定,可以用来做日常用的铝制品 |