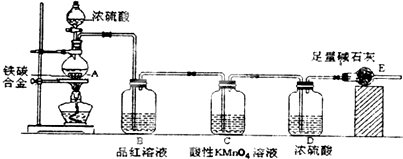
题目内容
7.苯分子中的一个氢原子被一个甲基取代后的产物叫甲苯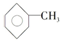 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 已知甲苯的一氯代物有4种,说明甲苯的等效氢有4种,甲苯完全氢化后的环烷烃等效氢会多出1种,即与甲基相连碳上有1个氢原子,据此解答.
解答 解:已知甲苯的一氯代物有4种,说明甲苯的等效氢有4种,甲苯完全氢化后的环烷烃等效氢会多出1种,即与甲基相连碳上有1个氢原子,甲苯完全氢化后的环烷烃等效氢有5种,则它的一氯代物就有5种,
故选:C.
点评 本题考查等效氢与一氯代物的关系,注意完全氢化后结构中氢原子的变化,题目难度适中,易错选B.

练习册系列答案
相关题目
18.A+、B2+、C-、D2- 四种离子核外电子排布相同,则这四种离子半径大小顺序是( )
| A. | C->D2->A+>B2+ | B. | B2+>A+>C->D2- | C. | B2+>A+>D2->C- | D. | D2->C->A+>B2+ |
15.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:
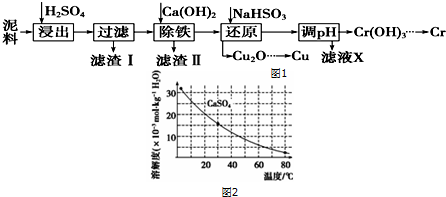
已知部分物质沉淀的pH如下表,CaSO4的溶解度曲线如图2:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4.
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围是3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].

已知部分物质沉淀的pH如下表,CaSO4的溶解度曲线如图2:
| 物质 | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围是3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
2.下列物质的性质递变规律正确的是( )
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
12.一定体积的甲烷在一定量O2中燃烧得到产物为CO,CO2和水蒸气,测得混合气体的质量为49.6g,将混合气体缓慢通过无水CaCl2时,CaCl2质量增加25.2g,则混合气体中CO2的质量为( )
| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
19.在光照条件下,将等物质的量的甲烷和氯气混合充分反应后,得到产物的物质的量最大的是( )
| A. | CH3Cl | B. | CHCl3 | C. | CCl4 | D. | HCl |
16.下列鉴别方法正确的是( )
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别NaAlO2溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |