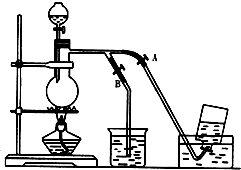
题目内容
12.一定体积的甲烷在一定量O2中燃烧得到产物为CO,CO2和水蒸气,测得混合气体的质量为49.6g,将混合气体缓慢通过无水CaCl2时,CaCl2质量增加25.2g,则混合气体中CO2的质量为( )| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重25.2g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量.
解答 解:产物通过无水CaCl2时,无水CaCl2增重25.2g为水的质量,
所以n(H2O)=$\frac{25.2g}{18g/mol}$=1.4mol,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×1.4mol=0.7mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,
m(CO)+m(CO2)=49.6g-25.2g=24.4g,
所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,
解之:n(CO2)=0.3mol,
所以生成二氧化碳的质量为0.3mol×44g/mol=13.2g.
故选:B.
点评 本题考查混合物的计算,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
20.下列叙述正确的是( )
| A. | NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 | |
| B. | CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心 | |
| C. | H2O是极性分子,分子中O原子和2个H原子不在一条直线上 | |
| D. | CO2是非极性分子,分子中C原子和2个O原子不在一条直线上 |
7.苯分子中的一个氢原子被一个甲基取代后的产物叫甲苯 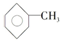 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
17.下列表达方法正确的是( )
| A. | Na2O的电子式: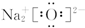 | B. | 硫离子的电子式: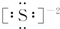 | ||
| C. | Na+的结构示意图: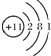 | D. | 碳-13:${\;}_{6}^{13}$C |
4.下表为元素周期表的一部分,请回答有关问题
(1)⑤和⑧的元素符号是Si和Ar.
(2)表中最活泼的金属元素是钾,形成化合物种类最多的元素是碳(填写元素名称).
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O.
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:Cl2+Na2S═2NaCl+S↓.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属元素是钾,形成化合物种类最多的元素是碳(填写元素名称).
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O.
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:Cl2+Na2S═2NaCl+S↓.
1.下列生活中的问题,不能用电子气理论知识解释的是( )
| A. | 铁易生锈 | B. | 用金属铝制成导线 | ||
| C. | 用金箔做外包装 | D. | 用铁制品做炊具 |
2.将CH3COOH和H18O-C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后的有关说法正确的是( )
| A. | 18O存在于所有物质里 | B. | 18O仅存在于乙醇和乙酸乙酯里 | ||
| C. | 18O仅存在于乙醇和水里 | D. | 只有乙酸乙酯分子中含18O |