题目内容
17.某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.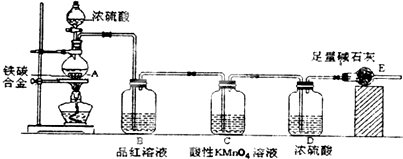
(1)将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,加热,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g.铁碳合金中铁的质量分数为$\frac{11a-3b}{11a}$×100%(写表达式).
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是铁、碳在酸溶液中形成原电池.
分析 由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)E增重b g为二氧化碳的质量,根据碳元素守恒计算合金中碳元素的质量,合金的质量减去碳元素质量等于铁的质量,再根据质量分数定义计算;
(2)增大反应速率的因素依据反应过程分析可知为升高温度,形成原电池反应等.
解答 解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)E增重b g为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为 $\frac{12}{44}$bg,合金中铁的质量为ag-$\frac{12}{44}$bg=(a-$\frac{3}{11}$b)g,故铁的质量分数=$\frac{a-\frac{3}{11}b}{m}$×10×%=$\frac{11a-3b}{11a}$×100%,
故答案为:$\frac{11a-3b}{11a}$×100%;
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,可能是铁和杂质碳在硫酸溶液中形成原电池反应,铁做负极发生氧化反应,加快反应速率,
故答案为:铁、碳在酸溶液中形成原电池.
点评 本题考查了学生对实验原理的理解、元素化合物性质、化学计算、原电池反应等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,题目难度中等.

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案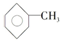 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 | |
| B. |  滴定达终点时,如图滴定管的正确读数为23.65 mL | |
| C. | 25℃时,在Mg(OH)2悬浊液中加入少量NH4Cl固体后,c(Mg2+)增大 | |
| D. | 测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
(1)上述实验中发生反应的离子方程式有:Zn+2H+═Zn2++H2↑、Zn+Cu2+═Zn2++Cu;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈暗红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积,使得生成氢气的速率下降.
④实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=0.01mol/(L•min)(忽略反应前后溶液体积变化).
| A. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| B. | 水晶镜片、石英钟表、玛瑙手镯含有SiO2 | |
| C. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 | |
| D. | 熔融烧碱时不能使用普通玻璃坩埚、石英坩埚和陶瓷坩埚 |
| A. | 18O存在于所有物质里 | B. | 18O仅存在于乙醇和乙酸乙酯里 | ||
| C. | 18O仅存在于乙醇和水里 | D. | 只有乙酸乙酯分子中含18O |
| A. | 利用氢氧化铁胶体的“丁达尔效应”,可以除去水中的悬浮颗粒,从而达到净水的效果 | |
| B. | 从分类的角度看,混合物、分散系、胶体的从属关系如图所示: | |
| C. | 通过观察外观的方法,即可将溶液、胶体和浊液区分开来 | |
| D. | 胶体中分散质粒子的运动是无规律的,溶液中分散质粒子的运动是有规律的 |
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | 全部 |
| A. | 用食醋,石灰水来验证蛋壳的成分是碳酸盐 | |
| B. | 用银氨溶液鉴别乙醇和乙醛 | |
| C. | 用酸性高锰酸钾验证苯中是否含有碳碳双键 | |
| D. | 用溴水鉴别乙烯和乙炔 |