题目内容
19.在光照条件下,将等物质的量的甲烷和氯气混合充分反应后,得到产物的物质的量最大的是( )| A. | CH3Cl | B. | CHCl3 | C. | CCl4 | D. | HCl |
分析 甲烷与氯气的取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,反应过程中,每取代甲烷中的1个H原子,都会同时生成1分子HCl气体,所以生成物中物质的量最大的是氯化氢.
解答 解:设甲烷和氯气的物质的量都是1mol,1mol甲烷和1mol氯气在光照条件下发生反应,生成有机物有CH3Cl、CH2Cl2、CHCl3、CCl4,根据碳原子守恒知,生成的各种氯代烃的物质的量都小于1mol,但生成的氯化氢的物质的量1mol,所以生成物的物质的量最多的产物是HCl,
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握甲烷取代反应的特点等为解答的关键,侧重分析与应用能力的考查,注意产物中含无机物HCl,题目难度不大.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- | |
| B. | 用加热法可除去NaHCO3中少量的Na2CO3 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液 |
10.下列反应离子方程式书写不正确的是( )
| A. | 硝酸银与氯化钾溶液的反应:Ag++Cl-═AgCl↓ | |
| B. | 硝酸与氢氧化钠溶液的反应:H++OH-═H2O | |
| C. | 碳酸钙与盐酸的反应:CO32-+2H+═CO2↑+H2O | |
| D. | 锌粒与稀硫酸的反应:Zn+2H+═Zn2++H2↑ |
7.苯分子中的一个氢原子被一个甲基取代后的产物叫甲苯 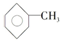 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
4.下表为元素周期表的一部分,请回答有关问题
(1)⑤和⑧的元素符号是Si和Ar.
(2)表中最活泼的金属元素是钾,形成化合物种类最多的元素是碳(填写元素名称).
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O.
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:Cl2+Na2S═2NaCl+S↓.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属元素是钾,形成化合物种类最多的元素是碳(填写元素名称).
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O.
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:Cl2+Na2S═2NaCl+S↓.
11.用溴水除去甲烷气体中的少量乙烯,其原理为乙烯能与溴发生( )
| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 聚合反应 |
8.下列有关实验的说法正确的是( )
| A. | 向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 | |
| B. | 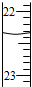 滴定达终点时,如图滴定管的正确读数为23.65 mL | |
| C. | 25℃时,在Mg(OH)2悬浊液中加入少量NH4Cl固体后,c(Mg2+)增大 | |
| D. | 测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
9.下列说法中,正确的是( )
| A. | 利用氢氧化铁胶体的“丁达尔效应”,可以除去水中的悬浮颗粒,从而达到净水的效果 | |
| B. | 从分类的角度看,混合物、分散系、胶体的从属关系如图所示: | |
| C. | 通过观察外观的方法,即可将溶液、胶体和浊液区分开来 | |
| D. | 胶体中分散质粒子的运动是无规律的,溶液中分散质粒子的运动是有规律的 |