题目内容
8.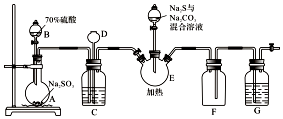 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
分析 (1)根据仪器构造可知为长颈漏斗;实验中由二氧化硫参与,污染空气,G用来除去多余的二氧化硫;
(2)二氧化硫能溶于水生成亚硫酸,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;
(3)①取少量溶液于小试管中,滴加足量BaCl2溶液,有白色沉淀生成,说明产品中可能含有Na2SO3、和被氧化的Na2SO4等杂质,将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口,排除掉Na2SO3的干扰,仍有白色沉淀,说明产品中含Na2SO4,品红试纸不褪色说明产品中不含Na2SO3;
(4)以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,终点现象为溶液变蓝色且半分钟内不褪色;依据反应的定量关系 2S2O32-+I2→S4O62-+2I-.计算碘单质消耗的硫代硫酸钠,计算得到样品中的质量分数;
(5)Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g,溶解度受温度影响较大,可用重结晶的方式提纯.
解答 解:(1)仪器D为长颈漏斗;G的作用是吸收二氧化硫,防止污染空气,选NaOH溶液;
故答案为:长颈漏斗;NaOH溶液;
(2)二氧化硫能溶于水生成亚硫酸,二氧化硫和亚硫酸钠、碳酸氢钠反应,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;
故答案为:b;
(3)①取少量溶液于小试管中,滴加足量BaCl2溶液,有白色沉淀生成,说明产品中可能含有Na2SO3、和被氧化的Na2SO4等杂质,将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口,排除掉Na2SO3的干扰,仍有白色沉淀,说明产品中含Na2SO4,品红试纸不褪色说明产品中不含Na2SO3;
故答案为:仍有白色沉淀;产品中不含Na2SO3;由Na2SO3或Na2S2O3被氧气氧化而成;
(4)以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,终点现象为溶液变蓝色且半分钟内不褪色;
根据反应的方程式可知,I2~2Na2S2O3,样品中Na2S2O3•5H2O的物质的量是:0.050mol/L×0.0200L×2×10=0.02mol,所以Na2S2O3•5H2O在产品中的质量分数为$\frac{0.02mol×248g/mol}{5g}×100%$=99.2%;
故答案为:溶液由无色变成蓝色且30 s不改变;99.2%;
(5)Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g,溶解度受温度影响较大,可用重结晶的方式提纯;
故答案为:重结晶.
点评 本题考查了物质性质的实验验证和实验方法应用,物质性质的掌握和实验基本操作是解题关键,题目难度中等.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案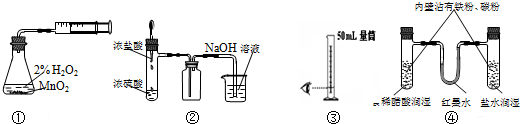
| A. | 装置①制取并收集纯净的氧气 | B. | 装置②制取并吸收HCl | ||
| C. | 装置③量取8.5mL的稀硫酸 | D. | 装置④模拟铁的腐蚀 |
| A. | pH=7的溶液中可能大量存在Fe3+、Cl-、Na+、S2- | |
| B. | 1 mol/L的FeCl3溶液滴入沸水中,得到分散质颗粒数为NA | |
| C. | 1 mol/L的Fe(NO3)2溶液中滴加盐酸,溶液变为黄色 | |
| D. | SO2与FeCl3溶液反应的离子方程式:2Fe3++SO2+4OH-=2Fe2++SO42-+2H2O |
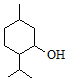
| A. | 薄荷醇分子式为C10H20O,它是环己醇的同系物 | |
| B. | 薄荷醇的分子中至少有12个原子处于同一平面上 | |
| C. | 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛 | |
| D. | 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应 |
| A. | 硅太阳能电池利用的是原电池原理 | B. | 草木灰与硝酸铵混成复合肥施用 | ||
| C. | 硅胶可用作瓶装药品的干燥剂 | D. | 用于发酵的小苏打属于碱 |
| A. | 饱和氯化钠溶液 | B. | 饱和碳酸氢钠溶液 | ||
| C. | 澄清石灰水 | D. | 氢氧化钠溶液 |
| A. | 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA | |
| B. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为$\frac{a}{56}$NA | |
| D. | 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA |