题目内容
16.写出下列元素基态原子的元素名称、元素符号及其价层电子构型和在周期表中的位置.(1)第4个稀有气体
(2)电负性最大的元素.
分析 (1)稀有气体包括氦、氖、氩、氪、氙和氡6种元素,其中第4个稀有气体是氪元素;
(2)电负性最大的元素是氟,由此解答.
解答 解:(1)稀有气体包括氦、氖、氩、氪、氙和氡6种元素,其中第4个稀有气体是氪、元素符号是Kr,价层电子构型为4s24p6,在周期表中的位置为第四周期,零族元素,故答案为:氪;Kr;4s24p6;第四周期,零族;
(2)电负性最大的元素是氟,元素符号是F,价层电子构型为2s22p5,在周期表中的位置为第二周期,第ⅤⅡA族元素,故答案为:氟;F;2s22p5;第二周期,第ⅤⅡA族.
点评 本题考查了核外电子排布和元素在周期表中位置的判断,题目难度不大,注意把握稀有气体的最外层电子排布为ns2np6是解题的关键.

练习册系列答案
相关题目
7.用高碘酸光度法测定低含量锰的方法误差约为2%.使用称量误差为±0.001g的天平称取MnSO4,若要配制成每毫升含0.2mg硫酸锰标准溶液,至少要配制( )
| A. | 50mL | B. | 250mL | C. | 100mL | D. | 1000mL | ||||
| E. | 500mL |
4.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色 | 原溶液一定有Na+,一定无K+ |
| C | NaI溶液$\stackrel{30%H_{2}O_{2}}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | 酸性条件下H2O2的氧化性比I2强 |
| D | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,溶液褪色 | 说明乙醇发生消去反应生成乙烯 |
| A. | A | B. | B | C. | C | D. | D |
11.下列指定反应的离子方程式正确的是( )
| A. | FeCl3溶液中加少量氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH${\;}_{4}^{+}$+H++SO${\;}_{4}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 惰性电极电解饱和NaCl溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2 | |
| D. | 向Na2SO3溶液中滴加足量NaClO溶液:SO${\;}_{3}^{2-}$+ClO-═SO${\;}_{4}^{2-}$+Cl- |
1.化学无处不在,下列与化学有关的说法错误的是( )
| A. | 生活中常见金属镁、铝、铁、铜等均能通过热还原法冶炼 | |
| B. | 古方记载:“青蒿一捏,以水二升渍,绞其汁”,所述过程不涉及化学变化 | |
| C. | 绿色化学的核心是减少和消除工业生产对环境的污染 | |
| D. | 通过煤的干馏、气化、液化能获得多种化工原料 |
8. 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
产品中形成Na2SO4的可能原因是由Na2SO3或Na2S2O3被氧气氧化而成.
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
5.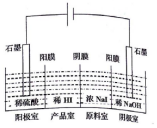 氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
 氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )| A. | 通电后,阴极室溶液pH增大 | |
| B. | 阳极电极反应式是2H2O-4e-═4H++O2↑ | |
| C. | 得到l mol产品HI,阳极室溶液质量减少8g | |
| D. | 通电过程中,NaI的浓度逐渐减小 |
6.下列描述正确的是( )
| A. | 氨气溶于水能导电,所以氨气是电解质 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO2 | |
| C. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| D. | 所有铵盐受热均可以分解,产物均有NH3 |