题目内容
13.从薄荷中提取的薄荷醇可制成医药.薄荷醇的结构简式如图,下列说法正确的是( )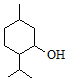
| A. | 薄荷醇分子式为C10H20O,它是环己醇的同系物 | |
| B. | 薄荷醇的分子中至少有12个原子处于同一平面上 | |
| C. | 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛 | |
| D. | 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应 |
分析 有机物含有羟基,可发生取代、氧化和消去反应,结合环烃的结构解答该题.
解答 解:A.由结构简式可知分子式为C10H20O,与环己醇结构相似,互为同系物,故A正确;
B.含有饱和碳原子,具有烷烃的结构特点,则12个原子不可能在同一平面上,故B错误;
C.不具有-CH2OH结构,则不能被氧化生成醛,故C错误;
D.不含不饱和键,不能发生加聚反应,故D错误.
故选A.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色 | 原溶液一定有Na+,一定无K+ |
| C | NaI溶液$\stackrel{30%H_{2}O_{2}}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | 酸性条件下H2O2的氧化性比I2强 |
| D | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,溶液褪色 | 说明乙醇发生消去反应生成乙烯 |
| A. | A | B. | B | C. | C | D. | D |
1.化学无处不在,下列与化学有关的说法错误的是( )
| A. | 生活中常见金属镁、铝、铁、铜等均能通过热还原法冶炼 | |
| B. | 古方记载:“青蒿一捏,以水二升渍,绞其汁”,所述过程不涉及化学变化 | |
| C. | 绿色化学的核心是减少和消除工业生产对环境的污染 | |
| D. | 通过煤的干馏、气化、液化能获得多种化工原料 |
8.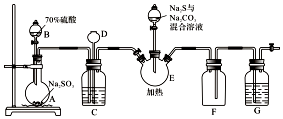 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
产品中形成Na2SO4的可能原因是由Na2SO3或Na2S2O3被氧气氧化而成.
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
5.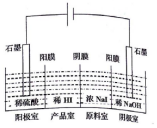 氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
 氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )| A. | 通电后,阴极室溶液pH增大 | |
| B. | 阳极电极反应式是2H2O-4e-═4H++O2↑ | |
| C. | 得到l mol产品HI,阳极室溶液质量减少8g | |
| D. | 通电过程中,NaI的浓度逐渐减小 |
2.为除去括号内的杂质,下列所选用的试剂或方法不正确的是( )
| A. | SiO2(CaCO3),加入过量的盐酸后过滤 | |
| B. | NaCl溶液(NaOH),加入适量的盐酸 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | FeSO4溶液[Fe2(SO4)3],加入适量的NaOH溶液 |
3.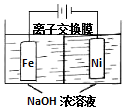 具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
 具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )
具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,其工作原理如图所示.下列叙述正确的是( )| A. | 电解一段时间后,阳极室的c(OH-)增大 | |
| B. | Na+由阴极室移向阳极室 | |
| C. | 阴极反应式:2H2O+2e-=H2↑+2OH- | |
| D. | 电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2 |
 +CaCl2+H2O.
+CaCl2+H2O.