题目内容
3.25℃时,关于指定溶液说法正确的是( )| A. | pH=7的溶液中可能大量存在Fe3+、Cl-、Na+、S2- | |
| B. | 1 mol/L的FeCl3溶液滴入沸水中,得到分散质颗粒数为NA | |
| C. | 1 mol/L的Fe(NO3)2溶液中滴加盐酸,溶液变为黄色 | |
| D. | SO2与FeCl3溶液反应的离子方程式:2Fe3++SO2+4OH-=2Fe2++SO42-+2H2O |
分析 A.铁离子能够氧化硫离子;
B.氢氧化铁胶粒为氢氧化铁的聚集体;
C.酸性条件下硝酸根离子能够氧化亚铁离子;
D.该反应中不存在氢氧根离子.
解答 解:A.Fe3+、S2-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.1 mol/L的FeCl3溶液滴入沸水中得到的是氢氧化铁胶体,氢氧化铁胶粒为氢氧化铁得到聚集体,则得到分散质颗粒数小于NA,故B错误;
C.1 mol/L的Fe(NO3)2溶液中滴加盐酸,硝酸根离子在酸性条件下具有强氧化性,能够将亚铁离子氧化成铁离子,所以溶液变为黄色,故C正确;
D.铁离子能够氧化二氧化硫,SO2与FeCl3溶液反应的离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列实验中没有白色沉淀或晶体析出的是( )
| A. | 饱和的石灰水中加入少量固体烧碱 | |
| B. | 饱和碳酸钠溶液中通入足量二氧化碳 | |
| C. | 氯化钙溶液中通入足量二氧化碳 | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液 |
11.下列指定反应的离子方程式正确的是( )
| A. | FeCl3溶液中加少量氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH${\;}_{4}^{+}$+H++SO${\;}_{4}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 惰性电极电解饱和NaCl溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2 | |
| D. | 向Na2SO3溶液中滴加足量NaClO溶液:SO${\;}_{3}^{2-}$+ClO-═SO${\;}_{4}^{2-}$+Cl- |
18.乙烯和丙烯属于同系物.下列叙述正确的是( )
| A. | 等质量的乙烯和丙烯完全燃烧耗氧量相同 | |
| B. | 丙烯分子中三个碳原子处于同一直线上 | |
| C. | 乙烯和丙烯与HCl加成均有两种产物 | |
| D. | 以丙烯为单体加聚可以生成 |
8.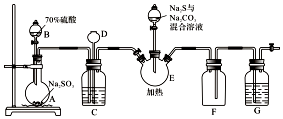 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
产品中形成Na2SO4的可能原因是由Na2SO3或Na2S2O3被氧气氧化而成.
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
15.采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取绿矾(FeSO4•7H2O),某学习小组设计了如图流程:下列说法错误的是( )
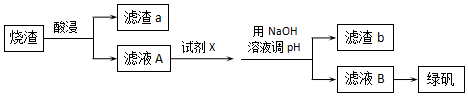

| A. | 酸浸时选用足量硫酸,试剂X为铁粉 | |
| B. | 滤渣a主要含SiO2,滤渣b主要含Al(OH)3 | |
| C. | 从滤液B得到绿矾产品的过程中,必须控制条件防止其氧化和分解 | |
| D. | 试剂X若为过量NaOH溶液,得到的沉淀用硫酸溶解,再结晶分离也可得绿矾 |
12.下列溶液中的各组离子能大量共存的是( )
| A. | 含0.1 mol•L-1 CO32-的溶液中:Na+、K+、AlO2-、Cl- | |
| B. | 能与A1反应产生气泡的溶液中:Fe2+、Mg2+、I-、NO3-、 | |
| C. | 使酚酞变红的溶液中:NH4+、Al2+、Cl-、SO42- | |
| D. | 0.1 mol•L-1的盐酸中:Ca2+、K+、NO3-、HCO3- |
13.下列说法正确的是( )
| A. | HNO3是挥发性一元酸 | |
| B. | Al2O3是金属氧化物、也是碱性氧化物 | |
| C. | 氧气和臭氧的相互转化是物理变化 | |
| D. | 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来 |