题目内容
19.将0.9gNaCl溶于1L纯净水中配成溶液,计算该溶液的质量分数、质量浓度、物质的量浓度、摩尔数和质量摩尔浓度.分析 依据ω=$\frac{溶质的质量}{溶液的质量}$;c=$\frac{n}{V}$;
质量浓度:单位体积混合物中某组分的质量;
摩尔数为:物质的物质的量;
质量摩尔浓度为:溶液中某溶质的物质的量除以溶剂的质量质量;
解答 解:将0.9gNaCl溶于1L纯净水中配成溶液,溶液的体积约为1L;
溶液的质量分数为:$\frac{0.9g}{(0.9+1000)g}$×100%=0.89%;
质量浓度:$\frac{0.9g}{1L}$=0.9g/L;
物质的量浓度:$\frac{\frac{0.9g}{58.5g/mol}}{1L}$=0.0154mol/L;
溶质的摩尔数:$\frac{0.9g}{58.5g/mol}$=0.0154mol;
质量摩尔浓度:$\frac{0.0154mol}{1Kg}$=0.0154mol/Kg;
答:该溶液的质量分数为0.89%、质量浓度0.9g/L、物质的量浓度0.0154mol/L、摩尔数0.0154mol、质量摩尔浓度0.0154mol/Kg.
点评 本题考查了溶液浓度的有关计算,明确相关浓度定义是解题关键,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
15.在pH=1的溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
10.下列溶液中,操作和现象对应不正确的是( )
| 选项 | 溶液 | 操作 | 现象 |
| A | 滴有酚酞的明矾溶液 | 加热 | 颜色变深 |
| B | 滴有酚酞的氨水 | 加入少量NH4Cl固体 | 颜色变浅 |
| C | 滴有酚酞的CH3COONa溶液 | 加入少量NH4NO3固体 | 颜色变浅 |
| D | 氯化铁溶液 | 加热 | 颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
7.用高碘酸光度法测定低含量锰的方法误差约为2%.使用称量误差为±0.001g的天平称取MnSO4,若要配制成每毫升含0.2mg硫酸锰标准溶液,至少要配制( )
| A. | 50mL | B. | 250mL | C. | 100mL | D. | 1000mL | ||||
| E. | 500mL |
4.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色 | 原溶液一定有Na+,一定无K+ |
| C | NaI溶液$\stackrel{30%H_{2}O_{2}}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | 酸性条件下H2O2的氧化性比I2强 |
| D | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,溶液褪色 | 说明乙醇发生消去反应生成乙烯 |
| A. | A | B. | B | C. | C | D. | D |
11.下列指定反应的离子方程式正确的是( )
| A. | FeCl3溶液中加少量氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH${\;}_{4}^{+}$+H++SO${\;}_{4}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 惰性电极电解饱和NaCl溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2 | |
| D. | 向Na2SO3溶液中滴加足量NaClO溶液:SO${\;}_{3}^{2-}$+ClO-═SO${\;}_{4}^{2-}$+Cl- |
8.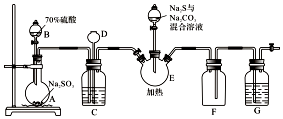 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
产品中形成Na2SO4的可能原因是由Na2SO3或Na2S2O3被氧气氧化而成.
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
9.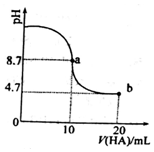 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( )
 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( )
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( )| A. | a 点所示溶液中 c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b 两点所示溶液中水的电离程度相问 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | pH=7时,c(Na+)-=c(A-)+c(HA) |