题目内容
18.利用下列实验装置能完成相应实验的是( )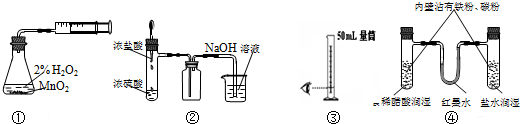
| A. | 装置①制取并收集纯净的氧气 | B. | 装置②制取并吸收HCl | ||
| C. | 装置③量取8.5mL的稀硫酸 | D. | 装置④模拟铁的腐蚀 |
分析 A.过氧化氢分解生成氧气,但装置中空气无法排出;
B.浓盐酸易挥发,浓盐酸与浓硫酸混合时放出热,HCl的密度比空气密度大,且与NaOH溶液反应,但导管在液面下可发生倒吸;
C.液体的体积应与量筒的规格接近,减小误差;
D.左侧电解质为酸,发生析氢腐蚀,右侧盐水为中性,发生吸氧腐蚀.
解答 解:A.过氧化氢分解生成氧气,但装置中空气无法排出,不能得到纯净的氧气,故A错误;
B.浓盐酸易挥发,浓盐酸与浓硫酸混合时放出热,HCl的密度比空气密度大,且与NaOH溶液反应,但导管在液面下可发生倒吸,则图中吸收尾气时选倒扣的漏斗防止倒吸,故B错误;
C.液体的体积应与量筒的规格接近,减小误差,应选10mL量筒量取8.5mL的稀硫酸,故C错误;
D.左侧电解质为酸,发生析氢腐蚀,右侧盐水为中性,发生吸氧腐蚀,则利于红墨水的移动可观察,装置④可模拟铁的腐蚀,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用、实验技能为解答本题的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.

练习册系列答案
相关题目
15.在pH=1的溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
13.下列实验中没有白色沉淀或晶体析出的是( )
| A. | 饱和的石灰水中加入少量固体烧碱 | |
| B. | 饱和碳酸钠溶液中通入足量二氧化碳 | |
| C. | 氯化钙溶液中通入足量二氧化碳 | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液 |
10.下列溶液中,操作和现象对应不正确的是( )
| 选项 | 溶液 | 操作 | 现象 |
| A | 滴有酚酞的明矾溶液 | 加热 | 颜色变深 |
| B | 滴有酚酞的氨水 | 加入少量NH4Cl固体 | 颜色变浅 |
| C | 滴有酚酞的CH3COONa溶液 | 加入少量NH4NO3固体 | 颜色变浅 |
| D | 氯化铁溶液 | 加热 | 颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
7.用高碘酸光度法测定低含量锰的方法误差约为2%.使用称量误差为±0.001g的天平称取MnSO4,若要配制成每毫升含0.2mg硫酸锰标准溶液,至少要配制( )
| A. | 50mL | B. | 250mL | C. | 100mL | D. | 1000mL | ||||
| E. | 500mL |
8.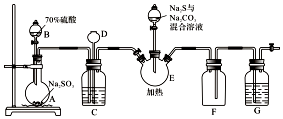 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
产品中形成Na2SO4的可能原因是由Na2SO3或Na2S2O3被氧气氧化而成.
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.
 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).已知:①Na2S2O3•5H2O是无色晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3.
③Na2S2O3在20℃和70℃时的溶解度分别为60.0g和212g
Ⅰ【制备产品】
实验装置如图所示(省略夹持装置):
(1)仪器D的名称是长颈漏斗;G中的试剂是NaOH溶液.
(2)装置C的作用之一是观察SO2的生成速率,其中的液体最好选择b.
a.蒸馏水 b.饱和NaHSO3溶液 c.饱和NaHCO3溶液
Ⅱ【纯度检验】
取所得产品5.0g,配成250mL溶液.
(3)填写表中的空白
| 实验方案 | 现象 | 结论 |
| ①取少量溶液于小试管中,滴加足量BaCl2溶液 | 有白色沉淀生成 | 产品中一定含有杂质 |
| ②将①所得混合液过滤,向洗涤后的沉淀滴加过量稀盐酸,加热,并用湿润的品红试纸置于管口 | 仍有白色沉淀 | 产品中含Na2SO4 |
| 品红试纸不褪色 | 产品中不含Na2SO3 |
(4)取25.00mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,用0.050mol/L的标准碘水溶液滴定,重复三次,平均消耗标准碘水20.00mL.滴定终点的现象是溶液由无色变成蓝色且30s不改变,产品中的Na2S2O3•5H2O的纯度为99.2%.(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
(5)粗Na2S2O3•5H2O可通过重结晶方法提纯.