题目内容
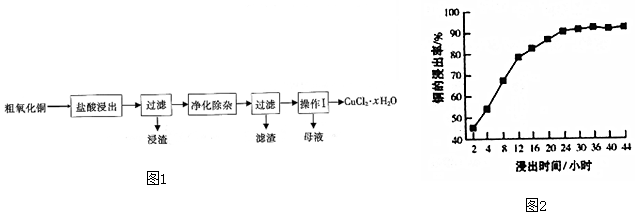
14.利用如图装置制取ClO2,并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.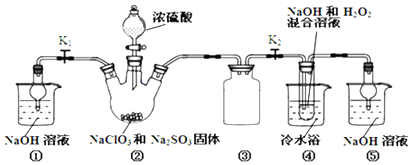
完成下列填空:
(1)装置②中产生ClO2的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;装置④中发生反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑.
(2)装置③的作用是防止倒吸;装置①和⑤在本实验中的作用吸收反应产生的气体,防止其污染空气.
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是防止生成NaClO2•3H2O晶体和温度过高产品分解.
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 mol•L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为当滴入一滴标准液,锥形瓶溶液由蓝色变为无色且半分钟内不变色.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为90.5%.
| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
分析 (1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式即可;二氧化氯和双氧水在碱性环境下反应获得NaClO2;
(2)装置③为安全瓶,防止倒吸,装置①和⑤吸收反应产生的气体,防止其污染空气;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,用38-60℃的温水洗涤;
(4)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-,计算得到样品中NaClO2的质量分数;
(5)NaClO2变质可分解为NaClO3和NaCl,方程式为3NaClO2=2NaClO3+NaCl,NaClO2试样与足量FeSO4溶液反应3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,运用氧化还原反应理论电子转移判断解答.
解答 解:(1)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和2Na2SO4,配平方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;装置④反应获得NaClO2,反应为:2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑;
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑;
(2)装置③为安全瓶,防止装置②中气体温度降低而产生倒吸,装置①和⑤吸收反应产生的气体,防止其污染空气;
故答案为:防止倒吸;吸收反应产生的气体,防止其污染空气;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,用38-60℃的温水洗涤,防止生成NaClO2•3H2O晶体和温度过高产品分解,故答案为:防止生成NaClO2•3H2O晶体和温度过高产品分解;
(4)碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色;3次测得数据如计算消耗硫代硫酸钠的体积是:$\frac{19.96+(23.30-3.26)+(23.40-1.10)}{3}$=20.77mL,
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-
n(ClO2-)=$\frac{1}{4}$n(S2O32-)=$\frac{1}{4}$×20.77×10-3×2.0≈0.01mol
m(NaClO2)=0.01×90.5=9.05g,
计算得到样品中NaClO2的质量分数=$\frac{9.05g}{10g}$×100%=90.5%;
故答案为:滴入最后一滴Na2S2O3标准液由蓝色变为无色且半分钟内不变色;90.5%;
(5)NaClO2变质可分解为NaClO3和NaCl,Cl元素从+3价变为+5价和-1价,反应为3NaClO2=2NaClO3+NaCl,NaClO2试样与足量FeSO4溶液反应3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,最终得到Cl元素由+3价变为-1价,所以NaClO2变质前后分别与Fe2+反应时,最终均得到等量NaCl,Cl元素均由+3价变为-1价,根据电子守恒,两个过程中得到的电子的物质的量相同,所以两份试样消耗FeSO4的物质的量相同,
故答案为:相同.
点评 本题考查了物质制备方法和实验设计,步骤理解应用,掌握物质性质和实验基本操作是解题关键,题目难度中等.

| A. | 用规格为10mL的量筒量取6.20mL的液体 | |
| B. | 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| C. | 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 | |
| D. | 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 |
| A. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,NA个CO2分子占有的体积约为22.4L | |
| D. | 氧气和臭氧的混合物16 g中含有NA个氧原子 |
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=-131.4 kJ•mol-1 |
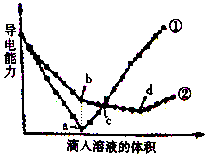 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.