题目内容
5.已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物,B溶于水得蓝色溶液,它们有如图所示的关系(反应中生成的水已略去).试回答下列问题.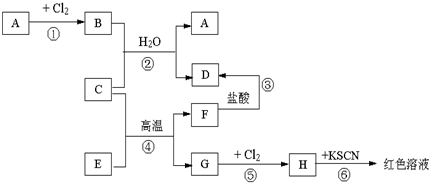
(1)推断填写物质化学式:A是Cu,D是AlCl3,H是FeCl3.
(2)反应④的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(3)用金属C制备另一种金属单质是工业上较常用的方法.如:2C+4BaO$\stackrel{高温}{→}$3Ba↑+BaO•C2O3
①常温下C的金属性比Ba的金属性弱(选填“强”“弱”).
②利用上述方法可制取Ba的主要原因是d.
a、高温时C的活泼性大于Ba
b、高温有利于BaO分解
c、高温时BaO•C2O3比C2O3稳定
d、金属Ba的沸点比金属C的低
(4)H水溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2
(5)将51.2克的A投入200毫升的硝酸溶液中恰好反应完全,产生标准状况下的NO2、NO共31.36L,求硝酸的浓度15 mol•L-1.
分析 A、C、G是金属,G和氯气反应生成H,H和KSCN反应后溶液呈红色,说明H是FeCl3,所以G是Fe,C是金属单质、E和F是氧化物,G是Fe单质,结合反应条件知④发生铝热反应,则C是Al,F是Al2O3,E是Fe2O3,
A是金属单质,和氯气反应生成氯化物,B溶于水得蓝色溶液,说明B中含有铜离子,根据元素守恒知,B为CuCl2,Al和CuCl2发生置换反应生成Cu和AlCl3,D是AlCl3,氧化铝和盐酸反应生成氯化铝,结合物质的性质分析解答.
解答 解:(1)通过以上分析知,A、D、H分别是:Cu、AlCl3、FeCl3,故答案为:Cu;AlCl3;FeCl3;
(2)铝和氧化铁发生铝热反应生成氧化铝和铁,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)①由金属元素在周期表中的位置可知Al的金属性比Ba弱,故答案为:弱;
②但Al在高温下可将氧化钡中钡置换出来,原因是Ba的沸点低于铝,高温时Ba转化为气体脱离反应体系,使反应正向进行,故答案为:d;
(4)氯化铁具有氧化性,碘化氢具有还原性,二者发生氧化还原反应生成氯化亚铁和碘单质,反应离子方程式为:2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(5)n(Cu)=$\frac{51.2g}{64g/mol}$=0.8mol,Cu和硝酸恰好完全反应生成NO2、NO,生成物还有Cu(NO3)2,根据N原子守恒得n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2×0.8mol+$\frac{31.36L}{22.4L/mol}$=3mol,c(HNO3)=$\frac{n}{V}$=$\frac{3mol}{0.2L}$=15mol/L,
故答案为:15.
点评 本题以铝、铁为载体考查了无机物的推断,明确物质的性质及物质的特殊反应现象是解本题关键,根据⑥为突破口采用正逆结合的方法进行推断,结合基本概念、物质间的反应分析解答,铁离子的检验是高考热点,会运用化学语言描述实验现象,根据现象得出结论,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | SO2、H2S | B. | NH3、CO2 | C. | Cl2、CO2 | D. | SO2、Cl2 |
| A. | 氢氧燃料电池在酸性介质中的正极反应式:O2+4H++4e-═2H2O | |
| B. | 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ | |
| D. | 反应HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0,在理论上能用于设计原电池 |
| A. | H2 (g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 | |
| B. | 2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2 | |
| D. | S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2 |
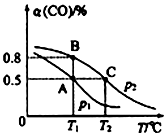
在10L的密闭容器中按物质的量之比1:2充入CO和H2,若充有10molCO发生反应:CO(g)+2H2(g)?CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(CO)/mol | 10 | 7 | 5 | 5 |
(2)你认为p1<p2(填“<”“>”或“=”)
(3)合成甲醇的反应为放热(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为Ka=Kb>Kc.
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有①③④⑤⑥.
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为-Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1-Q2)kJ/mol.
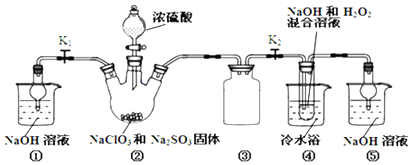
完成下列填空:
(1)装置②中产生ClO2的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;装置④中发生反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑.
(2)装置③的作用是防止倒吸;装置①和⑤在本实验中的作用吸收反应产生的气体,防止其污染空气.
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是防止生成NaClO2•3H2O晶体和温度过高产品分解.
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 mol•L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为当滴入一滴标准液,锥形瓶溶液由蓝色变为无色且半分钟内不变色.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为90.5%.
| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
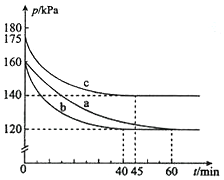
 一定温度下,将1mol A和1mol B气体充入2L密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1mol A和1mol B气体充入2L密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A. | 该反应方程式中的x=l | |
| B. | 0~t1时,用A表示的反应速率υ(A)=0.50mol/(L•min) | |
| C. | t2和t3时,改变的条件分别是加入催化剂和移去少量物质D | |
| D. | t1~t3间,该反应的平衡常数均为4 |
 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题.