题目内容
4.下列实验操作中正确的是( )| A. | 用规格为10mL的量筒量取6.20mL的液体 | |
| B. | 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| C. | 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 | |
| D. | 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 |
分析 A.量筒的最小读数为0.1mL;
B.氢氧化钠具有强腐蚀性,且易潮解,不能放在滤纸上称量;
C.可用蒸馏的方法分离沸点不同的混合物;
D.四氯化碳的密度大于水溶液.
解答 解:A.规格为10mL的量筒只能读到0.1mL,无法量取6.20mL的液体,故A错误;
B.称量氢氧化钠固体的质量时,由于氢氧化钠具有强腐蚀性、易潮解,应该将称量物放入烧杯中,不能直接放在滤纸上,故B错误;
C.液态混合物中沸点不同,则对液态混合物可以利用各组分的沸点不同用蒸馏的方法除去易挥发、难挥发或不挥发的杂质,故C正确;
D.用四氯化碳萃取碘水中的碘,由于四氯化碳的密度大于水溶液,则充分静置后紫红色液体在下层,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及仪器使用、物质分离与提纯方法等知识,明确常见化学实验基本操作方法为解答关键,注意掌握常见仪器的构造及使用方法,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 制取水泥和玻璃的原料中均有纯碱 | |
| B. | 普通玻璃是电的绝缘体,这种透明的固体物质是混合物,无固定的熔点 | |
| C. | 普通玻璃俗称水玻璃 | |
| D. | 硅酸盐工业使用的每一种原料都含有硅 |
16.将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
| A. | SO2、H2S | B. | NH3、CO2 | C. | Cl2、CO2 | D. | SO2、Cl2 |
13.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 氢氧燃料电池在酸性介质中的正极反应式:O2+4H++4e-═2H2O | |
| B. | 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ | |
| D. | 反应HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0,在理论上能用于设计原电池 |
14.利用如图装置制取ClO2,并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
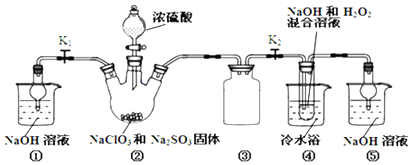
完成下列填空:
(1)装置②中产生ClO2的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;装置④中发生反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑.
(2)装置③的作用是防止倒吸;装置①和⑤在本实验中的作用吸收反应产生的气体,防止其污染空气.
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是防止生成NaClO2•3H2O晶体和温度过高产品分解.
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 mol•L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为当滴入一滴标准液,锥形瓶溶液由蓝色变为无色且半分钟内不变色.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为90.5%.
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2,其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同 (填“相同”“不相同”或“无法判断”).

完成下列填空:
(1)装置②中产生ClO2的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O;装置④中发生反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑.
(2)装置③的作用是防止倒吸;装置①和⑤在本实验中的作用吸收反应产生的气体,防止其污染空气.
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是防止生成NaClO2•3H2O晶体和温度过高产品分解.
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 mol•L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为当滴入一滴标准液,锥形瓶溶液由蓝色变为无色且半分钟内不变色.重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为90.5%.
| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |