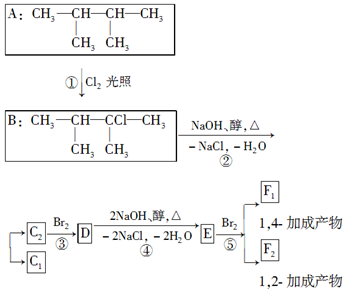
题目内容
5.二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.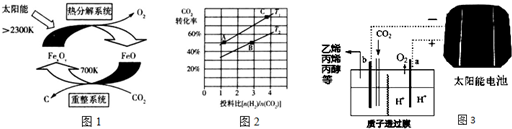
(1)科学家提出由CO2制取C的太阳能工艺如图1所示.
若“重整系统”发生的反应中$\frac{{n({FeO})}}{{n({C{O_2}})}}$=6,则FexOy的化学式为Fe3O4.
(2)工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
CH3OCH3(g)+H2O(g)=2CH3OH(g)△H2=+23.4kJ•mol-1
则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ•mol-1
(3)①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是b(填代号).
a.逆反应速率先增大后减小b.H2的转化率增大
c.反应物的体积百分含量减小d.容器中的$\frac{{n({C{O_2}})}}{{n({H_2})}}$值变小
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如图2所示.
T1温度下,将6mol CO2和12mol H2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=0.18mol•L-1•min-1
③上述合成二甲醚的过程中提高CO2的转化率可采取的措施有增大压强、降低温度(回答2点).
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH4+)>c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O?NH3•H2O+H2CO3的平衡常数K=1.25×10-3.(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5mol•L-1,H2CO3的电离平衡常数K1=4×10-7mol•L-1,K2=4×10-11mol•L-1)
(5)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图3所示.电解时其中b极上生成乙烯的电极反应式为2CO2+12H++12e-=C2H4+4H2O.
分析 (1)由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,根据原子守恒确定FexOy的化学式;(2)已知:①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
②CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),据此计算;
(3)①根据影响化学平衡的因素分析各选项;
②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×$\frac{1}{2}$=1.8mol,根据平均反应速率v=$\frac{△c}{△t}$计算;
③根据反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)为放热反应、气体体积减小,提高CO2的转化率的方法有增大压强、降低温度,从图可知投料比越大,转化越大;
(4)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=12×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,越弱越水解判断;反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})c(HC{{O}_{3}}^{-})}$=$\frac{c({H}^{+})c(O{H}^{-})}{K(N{H}_{3}•{H}_{2}O){K}_{1}}$计算;
(5)太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,乙烯在阴极生成.
解答 解:(1)由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4;
故答案为:Fe3O4;
(2)已知:①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
②CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ•mol-1;
故答案为:-130.8;
(3)①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,故错误;
b.H2的转化率增大,平衡一定正向移动,故正确;
c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,故错误;
d.容器中的$\frac{n(C{O}_{2})}{n({H}_{2})}$变小,可能是减小二氧化碳物质的量,平衡逆向移动,故错误;
故答案为:b;
②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×$\frac{1}{2}$=1.8mol,所以平均反应速率v(CH3OCH3)=$\frac{1.8mol÷2L}{5min}$=0.18mol•L-1•min-1;
故答案为:0.18mol•L-1•min-1;
③反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)为放热反应、气体体积减小,提高CO2的转化率,要求反应正向移动,方法有增大压强、降低温度,从图可知投料比越大,CO2的转化率也越大;
故答案为:增大投料比、增大压强、降低温度等;
(4)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,所以c(NH4+) 大于c(HCO3-);反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})c(HC{{O}_{3}}^{-})}$=$\frac{c({H}^{+})c(O{H}^{-})}{K(N{H}_{3}•{H}_{2}O){K}_{1}}$=$\frac{1{0}^{-14}}{2×1{0}^{-5}×4×1{0}^{-7}}$=1.25×10-3;
故答案为:>;1.25×10-3;
(5)电解时,二氧化碳在b极上生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O;
故答案为:2CO2+12H++12e-=C2H4+4H2O.
点评 本题考查化学平衡计算与影响因素、盖斯定律的应用、溶液的平衡以及原电池反应等知识,较为综合,考查对图象分析提取信息能力等,为高考常见题型,题目难度中等.

| A. | K越大,反应速率越大 | |
| B. | 对任一给定的可逆反应,温度升高,K值增大 | |
| C. | 对可逆反应,K值越大,反应物的转化率越高 | |
| D. | 加入催化剂或增大反应物浓度,K值将增大 |
| A. | 剩余固体是铁、铜混合物 | B. | 原固体混合物中铜的质量是12.4g | ||
| C. | 反应后溶液中n(Fe3+)=0.10mol | D. | 反应后溶液中n(Fe2+)+N(Cu2+)=1mol |
| A. | CH3COOH和Na2CO3与CH3COOH和NaHCO3 | |
| B. | AgNO3和HCl与Ag2SO4和HCl | |
| C. | BaCl2和Na2SO4与Ba(OH)2与H2SO4 | |
| D. | KOH和CH3COONH4与Ba(OH)2与NH4Cl |
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气.
(1)已知:H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1
2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
由此可知焦炭与水蒸气反应的热化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如表反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H,得到两组数据
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
(4)一定条件下,某密闭容器中已建立A(g)+B(g)?C(g)+D(g)△H>0的化学平衡,其时间速率图象如图1,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是A
A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$(g)+CO2(g)+2H2O(g)△H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO):V (NO2)=1:1.
(6)在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示.写出Y和Z的化学式:N2O、NO2.
| A. | 原子核内有8个中子的碳原子${\;}_{8}^{14}$C | |
| B. | 铁红的化学式:FeO | |
| C. | NH4Cl的电子式为 | |
| D. | Ca2+的结构示意图为 |


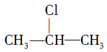 +NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,
+NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,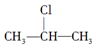 $→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系:
$→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系: