题目内容
17.为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
已知:①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ•mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ•mol-1和-283kJ•mol-1
则2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5kJ•mol-1
(2)将0.20mol NO和0.10mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示.

①CO在0-9min内的平均反应速率v(CO)=4.4×10-3mol•L-1•min-1(保留两位有效数字);第12min时改变的反应条件可能为D.
A.升高温度B.加入NO C.加催化剂D.降低温度
②该反应在第24min时达到平衡状态,CO2的体积分数为22.2%(保留三位有效数字),化学平衡常数值为3.4(保留两位有效数字).
(3)烟气中的SO2可用某浓度NaOH溶液吸收,若将一定量的SO2气体通入到300mL NaOH的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图2所示(气体的溶解和HCl的挥发忽略,NaHSO3水溶液为酸性):
①O点溶液中所含溶质的化学式为NaOH、Na2SO3;
②a点溶液中各离子溶度大小关系为c(Na+)>c(Cl-)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
分析 (1)已知①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1,又知C和CO的燃烧热(△H)分别为-393.5kJ•mol-1和-283kJ•mol-1,可得热化学方程式:②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1、③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1,根据盖斯定律,③×2-①可得:2NO(g)+2CO(g)═N2(g)+2CO2(g),据此计算出该反应的焓变;
(2)①根据v=$\frac{△c}{△t}$计算在0-9min内CO的平均反应速率v(CO);
12min时改变条件瞬间各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,结合平衡移动原理分析解答;
②由①中可知12min时为改变温度,重新到达平衡时NO为0.14mol/L、CO为0.04mol/L、氮气为0.03mol/L,由2NO(g)+2CO(g)═N2(g)+2CO2(g)可知二氧化碳为0.06mol/L,二氧化碳体积分数=$\frac{平衡时二氧化碳浓度}{混合气体总浓度}$×100%;根据K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{c(NO)•{c}^{2}(CO)}$计算平衡常数;
(3)①Na2SO3跟盐酸的反应是分步进行的:Na2SO3+HCl=NaHSO3+NaCl,NaHSO3+HCl=NaCl+H2O+SO2↑,由图象可知生成二氧化硫消耗的HCl的物质的量小于从反应到开始产生二氧化硫阶段消耗的HCl,则氢氧化钠与二氧化硫反应后的溶质为NaOH、Na2SO3;
②a点氢氧化钠、亚硫酸钠都恰好与HCl反应生成0.2mol亚硫酸氢钠、0.3mol氯化钠,结合盐的水解原理判断各离子浓度大小.
解答 解:(1)已知①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
又知C和CO的燃烧热(△H)分别为-393.5kJ•mol-1和-283kJ•mol-1
可得热化学方程式:②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
根据盖斯定律,③×2-①可得:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol,
故答案为:-746.5;
(2)①0-9min内CO浓度变化为:(0.1-0.06)mol/L=0.04mol/L,则CO在0-9min内的平均反应速率为:v(CO)=$\frac{0.04mol/L}{9min}$=4.4×10-3L-1•min-1,
根据图示可知,12min时改变条件瞬间,各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,正反应为放热反应,应是降低温度,
故答案为:4.4×10-3;D;
②由1中可知12min时为改变温度,重新到达平衡时NO为0.14mol/L、CO为0.04mol/L、氮气为0.03mol/L,由方程式2NO(g)+2CO(g)═N2(g)+2CO2(g)可知二氧化碳为0.06mol/L,则二氧化碳体积分数=$\frac{0.06}{0.14+0.04+0.03+0.06}$×100%=22.2%;
该反应在该温度下的平衡常数为:K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{c(NO)•{c}^{2}(CO)}$=$\frac{0.03×0.0{6}^{2}}{0.1{4}^{2}×0.0{4}^{2}}$=3.4,
故答案为:22.2%;3.4;
(3)①Na2SO3跟盐酸的反应是分步进行的:Na2SO3+HCl=NaHSO3+NaCl,NaHSO3+HCl=NaCl+H2O+SO2↑,由图象可知生成二氧化硫消耗的HCl的物质的量小于从反应到开始产生二氧化硫阶段消耗的HCl,则氢氧化钠与二氧化硫反应后的溶质为:NaOH、Na2SO3,
故答案为:NaOH、Na2SO3;
②0点溶质为NaOH、Na2SO3,根据反应Na2SO3+HCl=NaHSO3+NaCl,NaHSO3+HCl=NaCl+H2O+SO2↑可知,Na2SO3转化成NaHSO3消耗HCl的物质的量等于NaHSO3转化成二氧化硫消耗HCl的物质的量,故Na2SO3的物质的量为:0.5mol-0.3mol=0.2mol,则n(NaOH)=0.3mol-0.2mol=0.1mol,
根据Cl、Na元素守恒可知a点溶质为:0.3molNaCl、0.2molNaHSO3,钠离子和氯离子不水解,而HSO3-发生电离和水解,则c(Na+)>c(Cl-)c(HSO3-);NaHSO3水溶液为酸性,说明HSO3-的电离程度等于其水解程度,则c(H+)>c(OH-),溶液中还存在水电离的氢离子,则c(H+)>c(SO32-)>c(OH-),
所以a点溶液中离子浓度大小为:c(Na+)>c(Cl-)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(Cl-)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查了较为综合,涉及化学平衡常数、离子浓度大小比较、盖斯定律应用等知识,明确化学平衡及其影响为解答关键,注意掌握判断离子浓度大小的常用方法,试题培养了学生的分析、理解能力及灵活应用能力.

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘盐 | 20~40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时易分解
(3)碘元素的最低化合价为-1,最高化合价为+7,则碘酸钾在氧化还原反应中能表现出的性质为即有氧化性又有还原性(填:“只有氧化性”、“只有还原性”、“即有氧化性又有还原性”)
①氯水具有漂白性,可以是湿润有色布条褪色
②可溶性铁盐铝盐可用于净水
③Si-可用与制造光导纤维
④SiO2、Na2CO3和CaCO3可用于制玻璃
⑤水玻璃可用与生产防火材料
⑥铁红常用作红色油漆和涂料.
| A. | ③⑤ | B. | ④⑤ | C. | ③ | D. | ③④ |
| A. | 0.9 mol | B. | 0.8 mol | C. | 0.6mol | D. | 0.5 mol |
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2.
| A. | 全部 | B. | ③④⑤ | C. | 除④以外 | D. | ②⑤ |
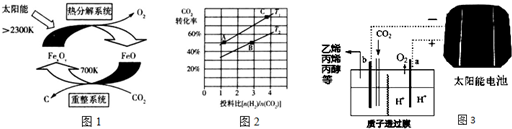
 烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
 ,D 的化学名称为苯乙炔.
,D 的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.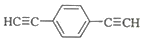 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n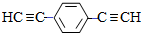 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$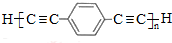 +(n-1)H2.
+(n-1)H2.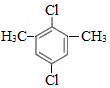 ,
, .
.