题目内容
20.水合肼(N2H4.H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl.据此,某学生设计了下列实验.【制备NaClO溶液】实验装置如图甲所示(部分夹持装置已省略)
已知:3NaClO$\frac{\underline{\;\;△\;\;}}{\;}$2NaCl+NaClO3

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有BD(填字母).
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置Ⅰ中发生的离子反应方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;Ⅱ中玻璃管a的作用为平衡压强;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是饱和食盐水;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的防止NaClO(歧化)分解为氯酸钠和氯化钠,影响水合肼的产率
【制取水合肼】实验装置如图乙所示
(3)仪器A的名称为三颈烧瓶;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4•H2O参与A中反应并产生大量氮气,产品产率因此降低,请
写出降低产率的相关化学反应方程式N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品.
【测定肼的含量】
(4)称取馏分0.3000g,加水配成20.0mL溶液,在一定条件下,用0.1500mol•L-1 的I2溶液滴定.
已知:N2H4•H2O+2I2=N2↑+4Hl+H2O.
①滴定时,可以选用的指示剂为淀粉溶液;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4.H2O的质量分数为25%.
分析 【制备NaClO溶液】装置Ⅰ:二氧化锰与浓盐酸反应制取氯气,制取的氯气中含有氯化氢,装置Ⅱ中玻璃管a的作用为平衡压强,氯气与氢氧化钠反应制备NaClO,Ⅱ中用冰水浴控制温度在30℃以下,防止NaClO(歧化)分解为氯酸钠和氯化钠,装置Ⅲ进行尾气处理.
(1)根据配制一定质量分数的溶液的步骤选用仪器;
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气与水;Ⅱ中玻璃管a的作用平衡压强,制取的氯气中含有氯化氢,为了提高NaClO的产率,需对I中产生的Cl2进行净化,用饱和的食盐水除去氯化氢,由已知信息可知,在反应极易发生副反应,Ⅱ中用冰水浴控制温度在30℃以下,所以这样做的目的是减少副反应的发生,提高水合肼的产率;
【制取水合肼】
(3)根据仪器A的特征以及常用仪器的名称分析解答;N2H4•H2O具有强还原性,容易被过量的NaClO氧化;
【测定肼的含量】
(4)①碘溶液遇淀粉变蓝色,肼反应完全,再滴入碘的标准溶液后,溶液变蓝色;
②根据方程式N2H4•H2O+2I2=N2↑+4HI+H2O计算.
解答 解:(1)配制30%NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,
故答案为:BD;
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,发生堵塞时,Ⅱ中压强增大,Ⅱ中长玻璃管中液面上升,形成水柱,可观察装置是否堵塞,作安全瓶,能平衡压强,氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,由于温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,所以冰水浴温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;平衡压强;饱和食盐水;防止NaClO(歧化)分解为氯酸钠和氯化钠,影响水合肼的产率;
(3)仪器A具有三个口特征的烧瓶,为三颈烧瓶,N2H4•H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,
故答案为:三颈烧瓶;N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
(4)①碘的标准溶液与肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:溶液出现蓝色且半分钟内不消失,所以选择淀粉为指示剂,
故答案为:淀粉溶液;
②设馏分中水合肼(N2H4•H2O)的质量分数为a,则:
N2H4•H2O+2I2=N2↑+4HI+H2O
50g 2mol
0.3000g×a 0.020L×0.15mol/L
所以50g:0.3000g×a=2mol:0.020L×0.15mol/L,解得:a=25%,
故答案为:25%.
点评 本题考查物质制备实验、物质含量测定,题目难度中等,明确实验目的为解答关键,较好地考查了学生对实验原理的理解、知识迁移应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 3Fe+4H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | Ca(OH)2+SO2═CaSO3+H2O | |
| D. | Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
| A. | 0.1mol•L-1的NaOH溶液:K+、Ba2+、Cl-、NO3- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1的FeCl3溶液:K+、NH4+、NO3-、Cl- | |
| D. | 0.1mol•L-1的HCl溶液:K+、Na2+、SO42-、CO32- |
①氯水具有漂白性,可以是湿润有色布条褪色
②可溶性铁盐铝盐可用于净水
③Si-可用与制造光导纤维
④SiO2、Na2CO3和CaCO3可用于制玻璃
⑤水玻璃可用与生产防火材料
⑥铁红常用作红色油漆和涂料.
| A. | ③⑤ | B. | ④⑤ | C. | ③ | D. | ③④ |
①在25℃、101kPa下,2g甲醇燃烧生成CO2和液态水时放热45kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-720kJ/mol.
②若适量的N2和O2完全反应,每生成23g NO2需要吸收17kJ热量N2(g)+2O2(g)═2NO2(g)△H=+68kJ/mol.
(2)断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ•mol-1)表是一些键能数据(KJ•mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 | H-F | 565 | F-F | 158 |
| H-H | 436 | H-N | 391 |
CH4(g)+4F2(g)═CF4(g)+4HF(g)△H
②根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g )△H=-46kJ•mol-1 计算N≡N的键能.
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(25℃、101kPa下测得的热量).
①该反应的热化学方程式为N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol.
②又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875 kJ.
| A. | 0.9 mol | B. | 0.8 mol | C. | 0.6mol | D. | 0.5 mol |
| A. | 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32- | |
| B. | 向AgCl沉淀中滴入稀KI溶液白色沉淀变黄,说明AgI比AgCl更难溶 | |
| C. | 先加入盐酸无沉淀,再加入BaCl2溶液产生白色沉淀,则试样中一定有SO42- | |
| D. | 盐溶液中加入NaOH微热,产生使湿润的红色石蕊试纸变蓝的气体,则一定是铵盐 |
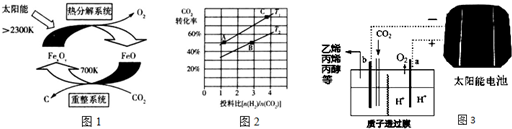
 烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为: