题目内容
10.中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气.
(1)已知:H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1
2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
由此可知焦炭与水蒸气反应的热化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如表反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H,得到两组数据
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
(4)一定条件下,某密闭容器中已建立A(g)+B(g)?C(g)+D(g)△H>0的化学平衡,其时间速率图象如图1,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是A
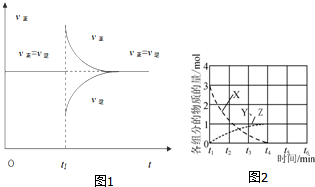
A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2.
①CH4(g)+4NO(g)$\stackrel{催化剂}{?}$2N2(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+2NO2(g)$\stackrel{催化剂}{?}$(g)+CO2(g)+2H2O(g)△H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO):V (NO2)=1:1.
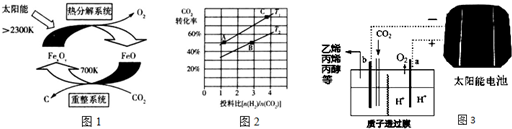
(6)在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示.写出Y和Z的化学式:N2O、NO2.
分析 Ⅰ.(1)用盖斯定律求反应热,根据目标方程式将已知方程式变形运算求解;
(2)根据碳酸和氢硫酸的两步电离平衡常数进行比较氢硫酸与碳酸、碳酸氢根离子离子酸性大小,从而得出反应产物,写出反应的离子方程式;
(3)利用实验1与实验2温度变化比较平衡常数来判断反应热,依据浓度商和平衡常数比较分析判断;
(4)根据图1t1时刻改变条件后v(正)瞬间增大,v(逆)减小,v(正)<v(逆),则平衡一定正向移动,据此分析;
Ⅱ.(5)依据一氧化氮、二氧化氮变化为氮气,甲烷变化为二氧化碳过程中电子转移守恒列式计算;
(6)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图象可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物.
解答 Ⅰ.(1)①H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H2=-221kJ•mol-1
盖斯定律计算得到②×$\frac{1}{2}$-①得到焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3 kJ•mol-1,
故答案为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3 kJ•mol-1;
(2)由于Ka2=5.61×10-11<Ka1=9.1×10-8<Ka1=4.30×10-7、Ka2=5.61×10-11>Ka2=1.1×10-12,所以氢硫酸能够与碳酸钠溶液反应生成碳酸氢钠和硫氢化钠,反应的离子方程式为:CO32-+H2S=HCO3-+HS-,
故答案为:CO32-+H2S=HCO3-+HS-;
(3)则实验1升高温度实验2,验2计算平衡常数,
H2O(g)+CO(g)?CO2(g)+H2(g)
初始 0.5mol/L 1mol/L 0 0
转化 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{0.2×0.2}{0.3×0.8}$=0.167,温度升高K变小,温度升高平衡向逆反应方向移动,正反应为放热反应,
按10mol C0,5mol H20,2mol C02,5mol H2,分别加入该容器
Qc=$\frac{\frac{2}{2}×\frac{5}{2}}{\frac{10}{2}×\frac{5}{2}}$=0.2>K
反应逆向进行,v(正)<v(逆),
故答案为:<;<;
(4)根据图1t1时刻改变条件后v(正)瞬间增大,v(逆)减小,v(正)<v(逆),则平衡一定正向移动,故选A,
故答案为:A;
Ⅱ.(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,设尾气中NO物质的量为x,NO2物质的量为y,2NO~N2~4e-,2NO2~N2~4e-,CH4~CO2~8e-,
2x+4y=$\frac{30g}{16g/mol}$×8=15mol
x+y=$\frac{1×1{0}^{4}L×1.12%}{22.4L/mol}$=5mol
计算得到x=2.5mol,y=2.5mol
尾气中V(NO):V(NO2)=1:1
故答案为:1:1;
(6)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2,
故答案为:N2O、NO2.
点评 本题综合考查化学平衡和化学反应速率等知识,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,此为化学平衡常考查问题,题目难度中等.

| A. | SiO2→H2SiO3 | B. | Na2SiO3→H2SiO3 | C. | NO→NO2 | D. | NH3→NO |
| A. | 2FeCO3(s)+O2(g)=Fe2O3(s)+2CO2(g)△H=-130 KJ/mol | |
| B. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=+130 KJ/mol |
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
(2)在体积不变的条件下,改变下列条件能使平衡常数变大的是A
A.升高温度 B.降低温度 C.加入催化剂 D.移出二氧化碳气体
(3)如要一开始加入0.04mol的CO、0.04mol的H2O、0.08mol的CO2和0.08mol的H2,在相同的条件下,反应达平衡时,c(CO)=0.03mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.12mol 的水蒸气,重新达到平衡后,CO的转化率升高(填“升高”、“降低”还是“不变”),CO2的质量分数降低(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,重新投料,测得在某一时刻c(CO)=c(H2O)=0.09mol/L,c(CO2 )=c(H2)=0.13mol/L,则此时v(正)<v(逆)(用“>”、“<”或“=”作答)
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
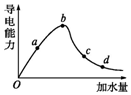 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图曲线所示,请回答.