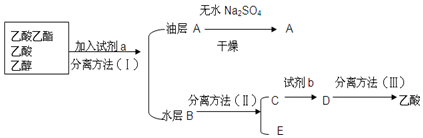
题目内容
15.关于平衡常数K,下列说法中正确的是( )| A. | K越大,反应速率越大 | |
| B. | 对任一给定的可逆反应,温度升高,K值增大 | |
| C. | 对可逆反应,K值越大,反应物的转化率越高 | |
| D. | 加入催化剂或增大反应物浓度,K值将增大 |
分析 平衡常数K只与温度有关,K越大,化学反应正向进行的趋势越大,以此来解答.
解答 解:A.K与反应速率无关,K大的反应速率可能小,故A错误;
B.反应可能为放热反应,升高温度,K碱性,故B错误;
C.对可逆反应,K值越大,正向进行的趋势越大,反应物的转化率越高,故C正确;
D.平衡常数K只与温度有关,加入催化剂或增大反应物浓度,K值将不变,故D错误;
故选C.
点评 本题考查化学平衡常数,为高频考点,把握K的意义及影响因素为解答的关键,侧重分析与应用能力的考查,注意可逆反应可能吸热或放热,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
3.下列叙述错误的是( )
| A. | 将少量CO2通入Na2SiO3溶液中会生成沉淀 | |
| B. | Li在氧气中充分燃烧,产物为Li2O | |
| C. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液呈红色 | |
| D. | 将过量的CO2气体通到NaAlO2溶液中可生成白色沉淀 |
10.下列反应不属于氧化还原反应的是( )
| A. | 3Fe+4H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | Ca(OH)2+SO2═CaSO3+H2O | |
| D. | Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
7.表是某地市场上销售的一种“加碘盐”包装袋上的部分文字说明.请根据此表结合初中学过的化学知识,回答下列问题:
(1)碘酸钾属于下列哪些类物质?(“纯净物”、“混合物”、“单质”、“化合物”、“酸”、“碱”、“盐”、“氧化物”)纯净物、盐
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时易分解
(3)碘元素的最低化合价为-1,最高化合价为+7,则碘酸钾在氧化还原反应中能表现出的性质为即有氧化性又有还原性(填:“只有氧化性”、“只有还原性”、“即有氧化性又有还原性”)
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘盐 | 20~40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时易分解
(3)碘元素的最低化合价为-1,最高化合价为+7,则碘酸钾在氧化还原反应中能表现出的性质为即有氧化性又有还原性(填:“只有氧化性”、“只有还原性”、“即有氧化性又有还原性”)
4.下列离子方程式正确的是( )
| A. | 过量CO2通入Ca(ClO)2溶液中:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| B. | 氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 向FeCl3溶液中加入铜粉:2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |