题目内容
16.铁铜混合粉末18.0g加入到100mL5.0mol•L-1FeCl3溶液中,充分反应后,剩余固体2.8g.下列说法正确的是( )| A. | 剩余固体是铁、铜混合物 | B. | 原固体混合物中铜的质量是12.4g | ||
| C. | 反应后溶液中n(Fe3+)=0.10mol | D. | 反应后溶液中n(Fe2+)+N(Cu2+)=1mol |
分析 铁比铜活泼,与FeCl3溶液反应时先后发生Fe+2Fe3+=3Fe2+、Cu+2Fe3+=Cu2++2Fe2+,原氯化铁溶液中含有氯化铁的物质的量为n(FeCl3)=5mol/L×0.1L=0.5mol,结合反应的方程式解答.
解答 解:A.铁的还原性强于铜,把铁、铜混合粉末加入氯化铁溶液中,铁先与铁离子反应,氯化铁的物质的量是0.5mol,
设0.5mol铁离子完全反应消耗铁、铜的质量分别为m1、m2,则:
Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+
64g 2mol 56g 2mol
m1 0.5mol m2 0.5mol
解得:m1=16g,m2=14g,
溶解的金属质量为:18g-2.8g=15.2g,14g<15.2g<16g,则铁完全反应、铜部分反应,且Fe3+完全反应,剩余的金属为Cu,故A、C错误;
B.设反应消耗铜的物质的量为n1,反应的铁的物质的量为n2,
则:①64n1+56n2=15.2g ②n1+n2=$\frac{1}{2}$n(Fe3+)=0.25mol,解得:n1=0.15mol、n2=0.1mol,
则原来混合物中含有的铜的质量为:0.15mol×64g/mol+2.8g=12.4g,故B正确;
C.Fe3+完全反应,剩余的金属为Cu,故C错误;
D.根据反应方程式可知反应后溶液中n(Fe2+)=2n(Cu)+3n(Fe)=2×0.15mol+3×0.10mol=0.6mol,
反应后溶液中铜离子的物质的量为n(Cu2+)=n(Cu)=0.15mol,故n(Fe2+)+n(Cu2+)=0.6mol+0.15mol=0.75mol,故D错误.
故选B.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意根据反应的相关方程式从质量守恒的角度解答,题目难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘盐 | 20~40mg/kg |
| 储藏方法 | 密封避光、防潮 |
| 使用方法 | 烹调时待食品熟后加入碘盐 |
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时易分解
(3)碘元素的最低化合价为-1,最高化合价为+7,则碘酸钾在氧化还原反应中能表现出的性质为即有氧化性又有还原性(填:“只有氧化性”、“只有还原性”、“即有氧化性又有还原性”)
| A. | 过量CO2通入Ca(ClO)2溶液中:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| B. | 氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 向FeCl3溶液中加入铜粉:2Fe3++Cu═Cu2++2Fe2+ | |
| D. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| A. | 0.1mol•L-1的NaOH溶液:K+、Ba2+、Cl-、NO3- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1mol•L-1的FeCl3溶液:K+、NH4+、NO3-、Cl- | |
| D. | 0.1mol•L-1的HCl溶液:K+、Na2+、SO42-、CO32- |
| A. | SiO2→H2SiO3 | B. | Na2SiO3→H2SiO3 | C. | NO→NO2 | D. | NH3→NO |
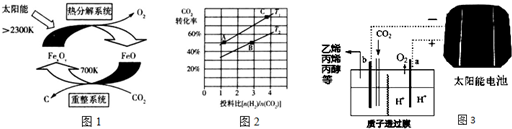
 ,D 的化学名称为苯乙炔.
,D 的化学名称为苯乙炔. .用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol.
.用1mol E合成1,4-二苯基丁烷,理论上需要消耗氢气4mol. )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为n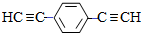 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$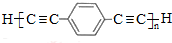 +(n-1)H2.
+(n-1)H2. ,
, .
.