题目内容
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图1所示(部分反应物、生成物没有列出),G常用作耐火材料,为主族元素的固态氧化物,A是一种金属单质,F是一种红褐色固体,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
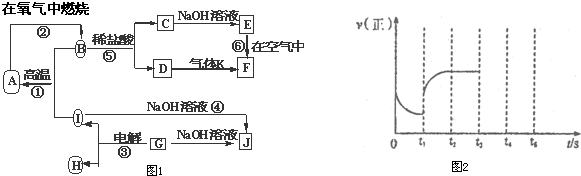
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置 .C溶液加热蒸干灼烧的产物是 .
(2)写出反应⑤的离子方程式 .
(3)若向气体K的水溶液中加入盐酸,室温下使其溶液的PH=7,则溶液中离子浓度由大到小的排列是 .
(4)已知:FeO(s)+CO(g)?Fe(s)+CO2(g);△H=-11kJ/mol.在1L的密闭容器中,投入7.2g FeO和0.1mol CO在定温条件下反应,该反应的正反应速率随时间变化情况如图2所示,在t1时改变了某种条件,反应在t2时达平衡,改变的条件可能是 .(选填字母)
a.升高温度 b.增大CO的浓度c.使用催化剂 d.增大压强.

(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置
(2)写出反应⑤的离子方程式
(3)若向气体K的水溶液中加入盐酸,室温下使其溶液的PH=7,则溶液中离子浓度由大到小的排列是
(4)已知:FeO(s)+CO(g)?Fe(s)+CO2(g);△H=-11kJ/mol.在1L的密闭容器中,投入7.2g FeO和0.1mol CO在定温条件下反应,该反应的正反应速率随时间变化情况如图2所示,在t1时改变了某种条件,反应在t2时达平衡,改变的条件可能是
a.升高温度 b.增大CO的浓度c.使用催化剂 d.增大压强.
考点:无机物的推断
专题:推断题
分析:G常用作耐火材料,为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3,与NaOH反应生成NaAlO2,而I也能与NaOH反应生成NaAlO2,则I为Al,H为O2,F是一种红褐色固体,由C→E→F的转化可知,E为Fe(OH)2,F为Fe(OH)3,A是一种金属单质,则A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,K为NH3,据此解答.
解答:
解:G常用作耐火材料,为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3,与NaOH反应生成NaAlO2,而I也能与NaOH反应生成NaAlO2,则I为Al,H为O2,F是一种红褐色固体,由C→E→F的转化可知,E为Fe(OH)2,F为Fe(OH)3,A是一种金属单质,则A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,K为NH3,
(1)A、B、C、D、E、F六种物质中所含金属元素为铁,位于周期表第四周期Ⅷ族,C为FeCl2,其溶液加热蒸干灼烧,水解得到氢氧化亚铁,加热灼烧时,氢氧化亚铁氧化为氢氧化铁,并分解得到氧化铁,
故答案为:第四周期Ⅷ族;Fe2O3;
(2)反应⑤为Fe3O4和盐酸的反应,反应的离子方程式为:Fe3O4+8H+=2 Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2 Fe3++Fe2++4H2O;
(3)若向气体NH3的水溶液中加入盐酸,室温下使其溶液的PH=7,则c(H+)=c(OH-),由电荷守恒可知c(NH4+)=(Cl-),则溶液中离子浓度大小关系为:c(NH4+)=(Cl-)>c(H+)=c(OH-),
故答案为:c(NH4+)=(Cl-)>c(H+)=c(OH-);
(4)由图象可知,开始正反应速率减小,反应正向进行,t1时刻改变条件,正反应速率突然增大,且正反应速率为增大的变化趋势,平衡向逆反应方向移动,反应是气体体积不变的放热反应,选项中的催化剂和压强改变不会发生平衡移动,一氧化碳量的增大会瞬间提高正反应速率,但随反应进行呈现减小趋势,温度升高平衡逆向进行,正反应速率增大最后达到平衡,
故选:a.
(1)A、B、C、D、E、F六种物质中所含金属元素为铁,位于周期表第四周期Ⅷ族,C为FeCl2,其溶液加热蒸干灼烧,水解得到氢氧化亚铁,加热灼烧时,氢氧化亚铁氧化为氢氧化铁,并分解得到氧化铁,
故答案为:第四周期Ⅷ族;Fe2O3;
(2)反应⑤为Fe3O4和盐酸的反应,反应的离子方程式为:Fe3O4+8H+=2 Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2 Fe3++Fe2++4H2O;
(3)若向气体NH3的水溶液中加入盐酸,室温下使其溶液的PH=7,则c(H+)=c(OH-),由电荷守恒可知c(NH4+)=(Cl-),则溶液中离子浓度大小关系为:c(NH4+)=(Cl-)>c(H+)=c(OH-),
故答案为:c(NH4+)=(Cl-)>c(H+)=c(OH-);
(4)由图象可知,开始正反应速率减小,反应正向进行,t1时刻改变条件,正反应速率突然增大,且正反应速率为增大的变化趋势,平衡向逆反应方向移动,反应是气体体积不变的放热反应,选项中的催化剂和压强改变不会发生平衡移动,一氧化碳量的增大会瞬间提高正反应速率,但随反应进行呈现减小趋势,温度升高平衡逆向进行,正反应速率增大最后达到平衡,
故选:a.
点评:本题考查无机物的推断、离子浓度大小比较、化学平衡图象等,物质的颜色及特殊反应为推断突破口,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是( )
| A、1 mol O2和1 mol N2所占的体积都约为22.4 L |
| B、H2的气体摩尔体积约为22.4 L |
| C、在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L |
| D、在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量约2 mol |
在下列实验中,不能达到目的是( )
| A、Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS,确定非金属性:Cl>S |
| B、用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜、镁的金属活动性强弱 |
| C、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 |
| D、测定NaCl和NaF溶液的pH,确定F、Cl两元素非金属性的强弱 |
酸HA的下列性质中,可以证明它是弱电解质的是( )
| A、1mol?L-1的HA溶液的pH约为3[计算公式:PH=-lgC(H+)] |
| B、HA能与水以任意比例互溶 |
| C、HA与盐酸都能与NaOH发生反应 |
| D、甲酸溶液可以导电 |
某铜片表面附着黑色固体,可能含有CuO、Cu2S、CuS.查阅资料得知:常温下,Cu2S和CuS都不溶于稀盐酸,在空气中煅烧都转化为Cu2O 和SO2.实验小组按如下实验方案探究其成分:

根据信息推测黑色固体的成分是( )

根据信息推测黑色固体的成分是( )
| A、只有CuO |
| B、CuO、Cu2S和CuS |
| C、CuO、CuS |
| D、CuO、Cu2S |
下列说法正确的是( )
| A、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
| B、在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ?mol-1 |
| C、在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ?mol-1 |
| D、在稀溶液中:H+ (aq)+OH- (aq)═H2O(l)△H=-57.31 kJ?mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.31 kJ |