题目内容
某铜片表面附着黑色固体,可能含有CuO、Cu2S、CuS.查阅资料得知:常温下,Cu2S和CuS都不溶于稀盐酸,在空气中煅烧都转化为Cu2O 和SO2.实验小组按如下实验方案探究其成分:

根据信息推测黑色固体的成分是( )

根据信息推测黑色固体的成分是( )
| A、只有CuO |
| B、CuO、Cu2S和CuS |
| C、CuO、CuS |
| D、CuO、Cu2S |
考点:铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:固体甲加入稀盐酸后,得到的蓝色溶液,说明固体含有CuO.
由Cu+O2=CuO可知增重,由Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.50g”,即实际减重了,说明必有CuS,还要有其他物质,讨论可能存在的情况可解答该题.
由Cu+O2=CuO可知增重,由Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.50g”,即实际减重了,说明必有CuS,还要有其他物质,讨论可能存在的情况可解答该题.
解答:
解:固体甲加入稀盐酸后,得到的蓝色溶液,说明固体含有CuO,
由Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.5g”,即实际减重了,说明必有CuS,
若甲全为CuS,4CuS+5O2
2Cu2O+4SO2
384 288
2g m
解得m=1.5g,
所以固体一定为CuO、CuS,
故选C.
由Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.5g”,即实际减重了,说明必有CuS,
若甲全为CuS,4CuS+5O2
| ||
384 288
2g m
解得m=1.5g,
所以固体一定为CuO、CuS,
故选C.
点评:本题考查物质的检验和鉴别的实验设计,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质以及质量的变化,为解答该题的关键,难度不大.

练习册系列答案
相关题目
若N0代表阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下11.2LN2含有的分子数为0.5N0 |
| B、9mL水和标准状况下11.2L氮气含有相同的分子数(注水的密度为1g/mL) |
| C、同温同压下,N0个NO与N0个N2和02的混合气体的体积相等 |
| D、25℃、1.01×105Pa时,11.2L氧气所含的原子数目为N0 |
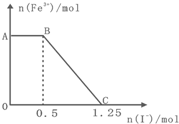 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液(假设I-与KMnO4反应的氧化产物为I2),混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )
| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 | ||||
| B、图中BC段发生的反应为2Fe3++2I-═2Fe2++I2通电 | ||||
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol | ||||
D、以Pt为电极材料电解C点的溶液,总反应式为2H2O
|
下列物质中,属于电解质的是( )
| A、氯化钾溶液 | B、澄清石灰水 |
| C、酒精 | D、氯化钠晶体 |
铜粉放入稀H2SO4中,加热后无明显现象,当加入一种盐后,铜粉质量减小,溶液变蓝,同时有气体逸出,此盐可能是( )
| A、FeSO4 |
| B、Na2CO3 |
| C、KNO3 |
| D、KCl |
实验室制取乙酸乙酯1mL后,沿小试管壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠层与乙酸乙酯层之间(整个过程不振荡试管),对可能出现的现象,叙述正确的是( )※重要提示:Na2CO3溶液显碱性.
| A、石蕊层仍为紫色 |
| B、石蕊层有两层,上层为紫色,下层为蓝色 |
| C、石蕊层为三层环,由上而下是蓝色、紫色、红色 |
| D、石蕊层为三层环,由上而下是红色、紫色、蓝色. |