题目内容
酸HA的下列性质中,可以证明它是弱电解质的是( )
| A、1mol?L-1的HA溶液的pH约为3[计算公式:PH=-lgC(H+)] |
| B、HA能与水以任意比例互溶 |
| C、HA与盐酸都能与NaOH发生反应 |
| D、甲酸溶液可以导电 |
考点:弱电解质的判断
专题:
分析:A.酸HA为一元酸,则利用PH=-lgC(H+)]求氢离子浓度,判断其电离是否完全电离来分析;
B.酸HA与水以任意比例互溶,这是酸HA的物理性质,不能证明是弱电解质;
C.酸都可以与碱发生中和反应,无电解质强弱无关;
D.溶液的导电性取决于自由移动离子浓度和自由移动离子带电数目;
B.酸HA与水以任意比例互溶,这是酸HA的物理性质,不能证明是弱电解质;
C.酸都可以与碱发生中和反应,无电解质强弱无关;
D.溶液的导电性取决于自由移动离子浓度和自由移动离子带电数目;
解答:
解:A.酸HA为一元酸,1mol/L氢氰酸溶液的pH=0时该酸为强酸,但pH约为3,说明电离生成的氢离子约为10-3mol/L<1mol/L,电离不完全,故A正确;
B.酸HA水溶性是物理性质,不能证明是弱电解质,故B错误;
C.不论酸碱强弱,只要是酸都可以与碱发生酸碱中和反应,不能证明是弱电解质,故C错误;
D.电解质强弱与溶液的导电性无关,溶液的导电性取决于自由移动离子浓度和自由移动离子带电数目,不能证明是弱电解质,故D错误;
故选A.
B.酸HA水溶性是物理性质,不能证明是弱电解质,故B错误;
C.不论酸碱强弱,只要是酸都可以与碱发生酸碱中和反应,不能证明是弱电解质,故C错误;
D.电解质强弱与溶液的导电性无关,溶液的导电性取决于自由移动离子浓度和自由移动离子带电数目,不能证明是弱电解质,故D错误;
故选A.
点评:本题考查了弱电解质的判断,题目难度不大,注意把握住弱电解质的定义“部分电离”的特点.

练习册系列答案
相关题目
0.5L的Fe2(SO4)3溶液中Fe3+的浓度为0.2mol/L,与0.2L0.5mol/L的Na2SO4溶液中SO42-的浓度之比是( )
| A、3:2 | B、2:5 |
| C、3:5 | D、5:3 |
如图示装置是化学实验室的常用装置,它有多种用途.以下各项用途的操作都正确的是( )


| A、洗气或干燥装置:瓶内放一定体积溶液,由a进气 |
| B、用于收集氢气:瓶内充满水,由b进气 |
| C、排空气收集H2:瓶内充满空气,由a进气 |
| D、病人输氧时用于观察输氧速度:瓶内装适量水,b接病人鼻腔 |
0.3mol硼烷(B2H6)在氧气中完全燃烧生成B2O3固体和液态水,放出649.5kJ热量.下列判断正确的是( )
| A、该反应是非氧化还原反应 |
| B、在理论上可以利用该反应的原理做成燃料电池 |
| C、该反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=2 165 kJ?mol-1 |
| D、每生成18 g水,该反应转移2 mol电子 |
铜粉放入稀H2SO4中,加热后无明显现象,当加入一种盐后,铜粉质量减小,溶液变蓝,同时有气体逸出,此盐可能是( )
| A、FeSO4 |
| B、Na2CO3 |
| C、KNO3 |
| D、KCl |
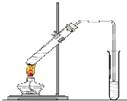 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: