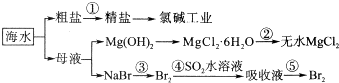
题目内容
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA | |
| C. | 0.1 mol•L-1氢氧化钠溶液中含钠离子数为0.1NA | |
| D. | 5.6 g铁与足量稀硫酸反应时失去电子数为0.2NA |
分析 A.氯化钠为离子晶体,不含分子;
B.一氧化氮和5.6L(0.25mol)氧气混合后发生反应生成0.25mol的二氧化氮,同时剩余氧气0.125mol,但生成的二氧化氮又能生成四氧化二氮,二者的反应为可逆反应;
C.溶液体积未知;
D.铁与稀硫酸反应生成硫酸亚铁.
解答 解:A.氯化钠固体为离子晶体,不存在分子,故A错误;
B.一氧化氮和5.6L(0.25mol)氧气混合后发生反应生成0.25mol的二氧化氮,同时剩余氧气0.125mol,但生成的二氧化氮又能生成四氧化二氮,二者的反应为可逆反应,则分子的总物质的量小于0.375mol,分子数小于0.375NA,故B错误;
C.溶液体积未知,无法计算钠离子个数,故C错误;
D.5.6g铁物质的量为0.1mol,与足量稀硫酸反应生成0.1mol二价铁离子,失去0.2NA电子,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算及应用,明确物质的量的计算公式和物质结构是解题关键,注意离子晶体、原子晶体、金属晶体都不含有分子,注意可逆反应不能进行到底,题目难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
12.W、R、X、Y的原子序数依次增大,Y的最高正价和最低负价之和等于0,L层上电子数是M层上电子数的2倍;在常温常压下,W和R组成的化合物有多种,其中两种化合物能相互转化,但元素化合价没有变化;这4种元素的原子最外层电子数之和等于R原子的核电荷数的2倍.下列说法正确的是( )
| A. | 元素的非金属性顺序为R>Y>W | |
| B. | R与其他三种元素均能形成共价化合物 | |
| C. | 简单氢化物的热稳定性顺序为R>W>Y | |
| D. | 原子半径次序为W>R>X>Y |
17.某有机物A的结构简式如图所示,有关叙述中正确的是( )
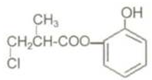

| A. | 有机物A与浓硫酸混合加热,可以发生消去反应 | |
| B. | 1molA和足量的H2发生加成反应,最多可以消耗4molH2 | |
| C. | 1molA和足量NaOH溶液发生反应,最多可以消耗 4molNaOH | |
| D. | 有机物A的同分异构体中能在稀硫酸下水解生成二苯酚的有6种 |
11.电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.右图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是 ( )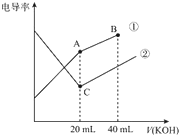

| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |