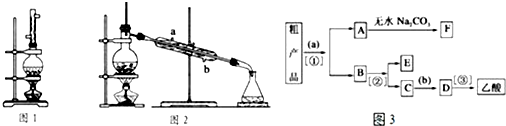
题目内容
10.(1)常温下某溶液中由水电离出的离子浓度符合c(H+)•c(OH-)=1×10-20的溶液,其pH为4或10,此时水的电离受到抑制.(2)已知:2NO2(g)═N2O4(g)△H=-57.20kJ•mol-1.一定温度下,在密闭容器中反应2NO2(g)═N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是BC(填字母).
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13 mol2•L-2,则该温度下:
①0.01mol•L-1NaOH溶液的pH=11;
②100mL 0.1mol•L-1H2SO4溶液与100mL 0.4mol•L-1的KOH溶液混合后,pH=12.
(4)已知一溶液有4种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是C.
A.c(Y-)>c(X+)>c(H+)>c(OH-) B.c(X+)>c(Y-)>c(OH-)>c(H+)
C.c(H+)>c(Y-)>c(X+)>c(OH-) D.c(OH-)>c(X+)>c(H+)>c(Y-)
(5)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应时溶液中c(NH${\;}_{4}^{+}$)=c(Cl-).则溶液显中(填“酸”“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$.
分析 (1)常温下某溶液中由水电离出的离子浓度符合c(H+)•c(OH-)=1×10-20的溶液中满足:c(H+)=c(OH-)=1×10-10mol/L,则该溶液抑制了水的电离,为酸性或碱性溶液;
(2)该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等,依据化学平衡移动原理分析选项;
(3)①在某温度下,H2O的离子积常数为1×10-13 mol2•L-2,0.01mol•L-1NaOH溶液中氢氧根离子浓度为0.01mol•L-1,则氢离子浓度为10-11mol/L,据此计算溶液PH;
②100mL 0.1mol•L-1H2SO4溶液与100mL 0.4mol•L-1的KOH溶液混合后恰反应后氢氧化钠溶液中氢氧根离子浓度过量,溶液显碱性,依据剩余氢氧根离子浓度和离子积常数计算溶液中氢离子浓度计算溶液PH;
(4)该溶液可能为中性、酸性、碱性溶液,但溶液中一定满足电荷守恒,根据电荷守恒进行判断;
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,根据NH3•H2O的电离常数Kb计算;
解答 解:(1)常温下某溶液中由水电离出的离子浓度符合c(H+)•c(OH-)=1×10-20的溶液中满足:c(H+)=c(OH-)=1×10-10mol/L,则该溶液抑制了水的电离,为酸性或碱性溶液,溶液的pH可能为4或10,
故答案为:4或10;抑制;
(2)该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等,
A.减小N02的浓度,平衡向逆反应方向移动,N02的转化率降低,故A错误;
B.降低温度,平衡向正反应方向移动,N02的转化率提高,故B正确;
C.增加N02的浓度,平衡向正反应方向移动,且体系压强增大,也利于反应向正反应方向移动,故C正确;
D.升高温度,平衡向逆反应方向移动,N02的转化率降低,故D错误;
故答案为:BC;
(3)①溶液中c(H+)=$\frac{1{0}^{-13}}{0.1}$mol/L=10-11 mol/L,pH=-lgc(H+)=-lg10-11=11,
故答案为:11;
②混合溶液中c(OH-)=$\frac{0.4mol/L×0.1L-0.1mol/L×2×0.1L}{0.1L+0.1L}$=0.1mol/L,c(H+)=$\frac{1{0}^{-13}}{0.1}$mol/L=10-12 mol/L,pH=-lgc(H+)=12,
故答案为:12;
(4)A.当溶液为酸性时,可以满足关系:c(Y-)>c(X+)>c(H+)>c(OH-),故A正确;
B.当溶液呈碱性时可以满足c(X+)>c(Y-)>c(OH-)>c(H+),故B正确;
C.该关系c(H+)>c(Y-)>c(X+)>c(OH-)无法了电荷守恒,故C错误;
D.当溶液呈碱性,且YOH远远过量时可以满足c(OH-)>c(X+)>c(H+)>c(Y-),故D正确;
故答案为:C;
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3•H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×5×1{0}^{-3}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中;$\frac{1{0}^{-9}}{a-0.01}$;
点评 本题考查离子浓度大小比较、盐类水解的应用及电解原理,为高频考点,题目难度中等,侧重于学生的分析能力的考查,明确盐类水解规律及酸性强弱的关系、电离平衡常数的计算、离子的放电顺序等即可解答.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案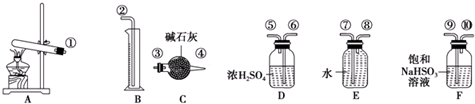
【提出猜想】
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2两种;
Ⅲ.所得气体的成分可能含有SO3、SO2、O2三种.
【实验探究】
实验操作过程略.
已知实验结束时,硫酸铜完全分解.
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为:①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→②(填接口序号).
(2)若实验结束时B中量筒没有收集到水,则证明猜想Ⅰ正确.
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
第一小组:2CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2↑+O2↑;
第二小组:4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑.
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:(1)氮气性质稳定,可用作保护气.请用电子式表示氮气的形成过程:
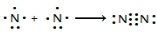 .
.(2)联氨(N2H4)是一种还原剂.已知:H2O(l)═H2O(g)△H=+44kJ/mol.试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-631.7kJ/mol.
| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(4)氨的催化氧化用于工业生产硝酸.该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:NH3-5e-+5OH-=NO+4H2O.
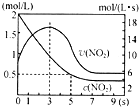
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2?N2O4其相关图象如图.
①0~3s时v(NO2)增大的原因是容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大.
②5s时NO2转化率为75%.
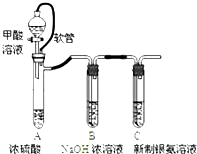 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
(2)装置A中软管的作用是平衡漏斗上下压强,使甲酸溶液能顺利滴下.
(3)为验证C中上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3(填化学式).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为10.8g.
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA | |
| C. | 0.1 mol•L-1氢氧化钠溶液中含钠离子数为0.1NA | |
| D. | 5.6 g铁与足量稀硫酸反应时失去电子数为0.2NA |
| A. | 1.6gCH4中含有的分子数 | |
| B. | 100 mL1mol/LH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下,22.4LCO气体中含有的分子数 |
 (R-CH3或-H)
(R-CH3或-H) $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$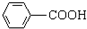
 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.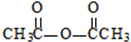 .
. .
.
 .(不用写条件)
.(不用写条件)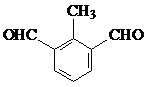 或
或  (任写一种即可).
(任写一种即可).