题目内容
将150mL稀盐酸(密度为1.1g/cm3)加入盛有53g含少量杂质的石灰石的烧杯中,恰好完全反应(杂质不溶于水,也不与稀盐酸及生成物反应),反应后烧杯中物质的总质量为196g,(计算保留一位小数).计算:(1)反应生成二氧化碳的质量;
(2)石灰石中含碳酸钙的质量分数;
(3)生成物溶液中溶质的质量分数.
(2)石灰石中含碳酸钙的质量分数;
(3)生成物溶液中溶质的质量分数.
考点:化学方程式的有关计算
专题:计算题
分析:(1)烧杯中物质减少的质量为生成二氧化碳的质量;
(2)由CaCO3+2HCl=CaCl2+H2O+CO2↑计算出发生反应的碳酸钙的质量和生成氯化钙的质量,并计算出石灰石中碳酸钙的质量分数;
(3)结合烧杯中剩余物的质量可以计算出所得溶液中溶质的质量分数.
(2)由CaCO3+2HCl=CaCl2+H2O+CO2↑计算出发生反应的碳酸钙的质量和生成氯化钙的质量,并计算出石灰石中碳酸钙的质量分数;
(3)结合烧杯中剩余物的质量可以计算出所得溶液中溶质的质量分数.
解答:
解:(1)只有二氧化碳为气体,由质量守恒可知,生成二氧化碳的质量为165g+53g-196g=22g,
答:生成二氧化碳的质量为22g;
(2)设石灰石中碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 22g
=
、
=
,
解得x=50g,y=55.5g
石灰石中碳酸钙的质量分数为
×100%≈94.3%,
答:石灰石中碳酸钙的质量分数为94.3%;
(3)生成物溶液中溶质的质量分数为
×100%≈28.8%,
答:生成物溶液中溶质的质量分数为28.8%.
答:生成二氧化碳的质量为22g;
(2)设石灰石中碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 22g
| 100 |
| x |
| 44 |
| 22g |
| 111 |
| y |
| 44 |
| 22g |
解得x=50g,y=55.5g
石灰石中碳酸钙的质量分数为
| 50g |
| 53g |
答:石灰石中碳酸钙的质量分数为94.3%;
(3)生成物溶液中溶质的质量分数为
| 55.5g |
| 196g-(53g-50g) |
答:生成物溶液中溶质的质量分数为28.8%.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的反应及反应中的质量关系为解答的关键,注意利用质量守恒确定二氧化碳的质量为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,当溶液中( )
| A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
| B、c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| C、c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
| D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,可能是氢氧化钠过量 |
下列实验操作不能达到预期目的是( )
| A、用饱和NaHCO3溶液除去CO2中少量的HCl |
| B、NH4C1和I2的固体混合物可以用加热的方法分离 |
| C、植物油和水的混合物可以用分液的方法分离 |
| D、溴水中的溴单质可以用四氯化碳萃取 |
下列说法正确的是( )
| A、浓硫酸有吸水性,可用于干燥氨气 |
| B、SiO2是酸性氧化物,能与NaOH溶液反应 |
| C、Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
| D、新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 |
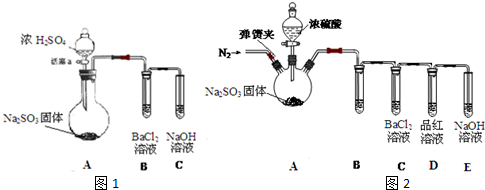
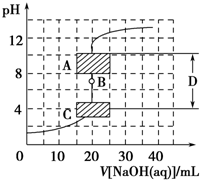 滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.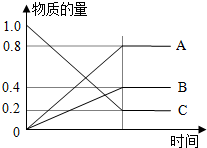 H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).