题目内容
某小组对过氧化钠的性质和用途进行探究.
(1)观察其外观,可获知的物理性质是 .
(2)将CuSO4溶液加入盛有少量Na2O2固体的试管中,可以观察到的现象是 ,发生反应的化学方程式依次为 .
(3)Na2O2可用于潜水艇中作为氧气的来源,若消耗100g Na2O2,能生成标准状况下多少体积的O2?(写出计算过程)
(1)观察其外观,可获知的物理性质是
(2)将CuSO4溶液加入盛有少量Na2O2固体的试管中,可以观察到的现象是
(3)Na2O2可用于潜水艇中作为氧气的来源,若消耗100g Na2O2,能生成标准状况下多少体积的O2?(写出计算过程)
考点:钠的重要化合物,化学方程式的有关计算
专题:
分析:(1)根据观察其颜色、气味、状态可获相应的物理性质;
(2)根据将CuSO4溶液加入盛有少量Na2O2固体的试管中,发生反应的化学方程式判断;
(3)根据2Na2O2+2CO2=2Na2CO3+O2,结合消耗100g Na2O2计算;
(2)根据将CuSO4溶液加入盛有少量Na2O2固体的试管中,发生反应的化学方程式判断;
(3)根据2Na2O2+2CO2=2Na2CO3+O2,结合消耗100g Na2O2计算;
解答:
解:(1)观察Na2O2外观,可获知Na2O2在常温下为淡黄色固体,故答案为:Na2O2在常温下为淡黄色固体;
(2)将CuSO4溶液加入盛有少量Na2O2固体的试管中,发生化学方程式为2Na2O2+2H2O=4NaOH+O2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;所以看到的现象为有气泡产生,溶液中产生蓝色沉淀;故答案为:有气泡产生,溶液中产生蓝色沉淀;2Na2O2+2H2O=4NaOH+O2↑;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(3)设标准状况下产生氧气的体积为x
2Na2O2+2CO2=2Na2CO3+O2
2×78g 22.4L
100g x
=
,解得x=14.36 L
答:标准状况下产生氧气的体积为14.36 L.x=14.36 L;
(2)将CuSO4溶液加入盛有少量Na2O2固体的试管中,发生化学方程式为2Na2O2+2H2O=4NaOH+O2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;所以看到的现象为有气泡产生,溶液中产生蓝色沉淀;故答案为:有气泡产生,溶液中产生蓝色沉淀;2Na2O2+2H2O=4NaOH+O2↑;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(3)设标准状况下产生氧气的体积为x
2Na2O2+2CO2=2Na2CO3+O2
2×78g 22.4L
100g x
| 100 |
| 2×78 |
| x |
| 22.4 |
答:标准状况下产生氧气的体积为14.36 L.x=14.36 L;
点评:本题考查了过氧化钠的性质难度较大,注意过氧化钠与溶液反应先与水反应生成氢氧化钠,后氢氧化钠再与溶质反应,难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
已知某氧化剂XO3-中+5价的X能被Na2SO3还原成0价,则还原含有2.4×10-3molXO3-的溶液,需0.2mol?L-1的Na2SO3溶液的体积为( )
| A、40mL | B、30mL |
| C、20mL | D、10mL |
光导纤维的主要成分是( )
| A、Si |
| B、SiO2 |
| C、Na2SiO3 |
| D、SiCl4 |
H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ/mol下列说法正确的是( )
已知:
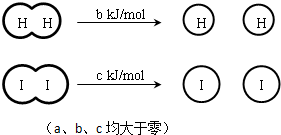
已知:

| A、H2、I2和HI分子中的化学键都是非极性共价键 |
| B、断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ |
| C、相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 |
| D、向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
 按要求回答下列问题:
按要求回答下列问题: