题目内容
SO2是常见的大气污染物,燃煤是产生SO2的主要原因.工业上有多种方法可以减少SO2的排放.
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙.该反应的化学方程式是 .
(2)可用多种溶液做燃煤烟气中SO2的吸收液.
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHSO3时,两种吸收液体积比V(Na2SO3):V(NaOH)= .
②NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是 .
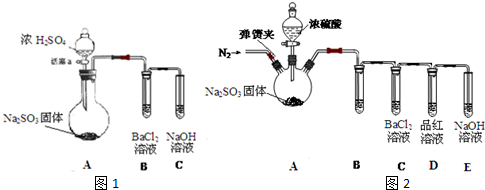
(3)甲同学认为BaCl2溶液可以做SO2的吸收液.为此甲同学设计如下实验(夹持装置和加热装置略图1、图2,气密性已检验):
已知:Na2SO3(固体)+H2SO4(浓)
Na2SO4+SO2↑+H2O反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀.甲同学认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2
溶液可做SO2吸收液.乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀.
②为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去.
③试管B中试剂是 溶液;滴加浓硫酸之前的操作是 .
④通过甲乙两位同学的实验,得出的结论是 .

(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙.该反应的化学方程式是
(2)可用多种溶液做燃煤烟气中SO2的吸收液.
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHSO3时,两种吸收液体积比V(Na2SO3):V(NaOH)=
②NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是
(3)甲同学认为BaCl2溶液可以做SO2的吸收液.为此甲同学设计如下实验(夹持装置和加热装置略图1、图2,气密性已检验):
已知:Na2SO3(固体)+H2SO4(浓)
| ||
溶液可做SO2吸收液.乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀.
②为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去.
③试管B中试剂是
④通过甲乙两位同学的实验,得出的结论是
考点:二氧化硫的污染及治理,性质实验方案的设计
专题:
分析:(1)根据反应物、生成物和反应条件书写化学方程式;
(2)①根据Na2SO3+SO2+H2O═2NaHSO3,NaOH+SO2═NaHSO3分析解答;
②NaOH溶液吸收了足量的SO2后生成NaHSO3,与一定量的石灰水溶液充分反应生成亚硫酸钙、氢氧化钠、水;
(3)二氧化硫具有还原性易被氧气氧化成三氧化硫,三氧化硫与水反应生成硫酸,与BaCl2溶液反应生成BaSO4沉淀;
③为证明SO2与BaCl2溶液不能得到BaSO3沉淀,可通入氮气排出装置中的氧气;④通过甲乙两位同学的实验现象进行对比分析;
(2)①根据Na2SO3+SO2+H2O═2NaHSO3,NaOH+SO2═NaHSO3分析解答;
②NaOH溶液吸收了足量的SO2后生成NaHSO3,与一定量的石灰水溶液充分反应生成亚硫酸钙、氢氧化钠、水;
(3)二氧化硫具有还原性易被氧气氧化成三氧化硫,三氧化硫与水反应生成硫酸,与BaCl2溶液反应生成BaSO4沉淀;
③为证明SO2与BaCl2溶液不能得到BaSO3沉淀,可通入氮气排出装置中的氧气;④通过甲乙两位同学的实验现象进行对比分析;
解答:
解:(1)根据题意,碳酸钙与二氧化硫、氧气在高温条件下反应生成硫酸钙,同时生成二氧化碳,所以反应的方程式为:2CaCO3+2SO2+O2
2CaSO4+2CO2,
故答案为:2CaCO3+2SO2+O2
2CaSO4+2CO2;
(2)①假设生成的NaHSO3物质的量都为2mol,Na2SO3+SO2+H2O═2NaHSO3,吸收的二氧化硫的物质的量为2mol,需1molNa2SO3,NaOH+SO2═NaHSO3,吸收的二氧化硫的物质的量也为2mol,需2molNaOH,假设Na2SO3溶液和NaOH溶液的物质的量浓度都为Cmol/L,两种吸收液体积比V(Na2SO3):V(NaOH)=
:
=1:2,
故答案为:1:2;
②NaOH溶液吸收了足量的SO2发生反应:NaOH+SO2═NaHSO3,与一定量的石灰水溶液充分反应NaHSO3+Ca(OH)2=CaSO3↓+NaOH+H2O,离子反应为:Ca2++OH-+HSO3-=CaSO3↓+H2O,使NaOH溶液再生,
故答案为:Ca2++OH-+HSO3-=CaSO3↓+H2O;
(3)二氧化硫具有还原性易被氧气氧化成三氧化硫,与BaCl2溶液反应,三氧化硫与水反应生成硫酸,H2SO4+BaCl2=BaSO4↓+2HCl,
故答案为:A中产生的SO2与装置内空气中的O2进入B中与BaCl2溶液反应生成BaSO4沉淀;
③滴加浓硫酸之前打开弹簧夹,通入N2,排出装置中的氧气,然后滴加浓硫酸,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,A中产生的白雾是浓硫酸的酸雾,所以B中的试剂是饱和NaHSO3,除去白雾,
故答案为:饱和NaHSO3;打开弹簧夹,通入N2,一段时间后关闭弹簧夹;
④通过甲乙两位同学的实验,得出的结论是SO2与BaCl2溶液不能得到BaSO3沉淀;不能用BaCl2溶液做吸收SO2的吸收液,
故答案为:SO2与BaCl2溶液不能得到BaSO3沉淀;不能用BaCl2溶液做吸收SO2的吸收液;
| ||
故答案为:2CaCO3+2SO2+O2
| ||
(2)①假设生成的NaHSO3物质的量都为2mol,Na2SO3+SO2+H2O═2NaHSO3,吸收的二氧化硫的物质的量为2mol,需1molNa2SO3,NaOH+SO2═NaHSO3,吸收的二氧化硫的物质的量也为2mol,需2molNaOH,假设Na2SO3溶液和NaOH溶液的物质的量浓度都为Cmol/L,两种吸收液体积比V(Na2SO3):V(NaOH)=
| 1 |
| C |
| 2 |
| C |
故答案为:1:2;
②NaOH溶液吸收了足量的SO2发生反应:NaOH+SO2═NaHSO3,与一定量的石灰水溶液充分反应NaHSO3+Ca(OH)2=CaSO3↓+NaOH+H2O,离子反应为:Ca2++OH-+HSO3-=CaSO3↓+H2O,使NaOH溶液再生,
故答案为:Ca2++OH-+HSO3-=CaSO3↓+H2O;
(3)二氧化硫具有还原性易被氧气氧化成三氧化硫,与BaCl2溶液反应,三氧化硫与水反应生成硫酸,H2SO4+BaCl2=BaSO4↓+2HCl,
故答案为:A中产生的SO2与装置内空气中的O2进入B中与BaCl2溶液反应生成BaSO4沉淀;
③滴加浓硫酸之前打开弹簧夹,通入N2,排出装置中的氧气,然后滴加浓硫酸,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,A中产生的白雾是浓硫酸的酸雾,所以B中的试剂是饱和NaHSO3,除去白雾,
故答案为:饱和NaHSO3;打开弹簧夹,通入N2,一段时间后关闭弹簧夹;
④通过甲乙两位同学的实验,得出的结论是SO2与BaCl2溶液不能得到BaSO3沉淀;不能用BaCl2溶液做吸收SO2的吸收液,
故答案为:SO2与BaCl2溶液不能得到BaSO3沉淀;不能用BaCl2溶液做吸收SO2的吸收液;
点评:本题考查了二氧化硫性质的实验验证分析判断,物质性质的分析,装置特征的判断,反应条件的应用是解题关键,题目难度中等.

练习册系列答案
相关题目
 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A、A点与B点相比,A点的c( Fe3+)大 |
| B、反应处于D点时,一定有v正<v逆 |
| C、加入KCl固体可以使溶液由D点变到C点 |
| D、若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2 |
下列有关主族元素形成的离子的叙述正确的是( )
| A、单核阳离子的电子层结构(除氢外)一定与上一周期稀有气体原子相同 |
| B、单核阳离子的电子层数一定比其他原子的电子层数少 |
| C、单核阴离子的半径一定比其原子半径大 |
| D、单核阴离子最外层一定是八电子结构 |
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注.
U是一种重要的核燃料,这里的“235”是指该原子的( )
235 92 |
| A、质量数 | B、质子数 |
| C、中子数 | D、电子数 |

 R-CH2CH2OH;
R-CH2CH2OH;