题目内容
下列说法正确的是( )
| A、浓硫酸有吸水性,可用于干燥氨气 |
| B、SiO2是酸性氧化物,能与NaOH溶液反应 |
| C、Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 |
| D、新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 |
考点:浓硫酸的性质,氯气的化学性质,硅和二氧化硅,钠的重要化合物
专题:元素及其化合物
分析:A.氨水具有碱性,浓硫酸不能干燥氨气;
B.SiO2是酸性氧化物,能与碱反应:SiO2+2NaOH=Na2SiO3+H2O;
C.铁和水蒸气反应生成四氧化三铁和氢气;
D.次氯酸有强氧化性,能漂白有色物质.
B.SiO2是酸性氧化物,能与碱反应:SiO2+2NaOH=Na2SiO3+H2O;
C.铁和水蒸气反应生成四氧化三铁和氢气;
D.次氯酸有强氧化性,能漂白有色物质.
解答:
解:A.氨水具有碱性,浓硫酸具有酸性,不能干燥氨气,故A错误;
B.因SiO2是酸性氧化物,能与碱反应:SiO2+2NaOH=Na2SiO3+H2O,故B正确;
C.过氧化钠和水反应生成氢氧化钠和氧气,铁和水蒸气反应生成四氧化三铁和氢气,故C错误.
D.氯气和水反应生成盐酸和次氯酸,导致其水溶液呈酸性,次氯酸有强氧化性,能使有色物质褪色,所以向新制氯水中滴加少量紫色石蕊溶液,溶液先变红后褪色,故D错误.
故选B.
B.因SiO2是酸性氧化物,能与碱反应:SiO2+2NaOH=Na2SiO3+H2O,故B正确;
C.过氧化钠和水反应生成氢氧化钠和氧气,铁和水蒸气反应生成四氧化三铁和氢气,故C错误.
D.氯气和水反应生成盐酸和次氯酸,导致其水溶液呈酸性,次氯酸有强氧化性,能使有色物质褪色,所以向新制氯水中滴加少量紫色石蕊溶液,溶液先变红后褪色,故D错误.
故选B.
点评:本题综合考查元素化合物知识,为高考常见题型和高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ/mol下列说法正确的是( )
已知:
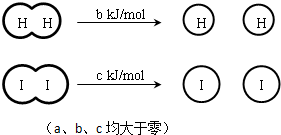
已知:

| A、H2、I2和HI分子中的化学键都是非极性共价键 |
| B、断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ |
| C、相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 |
| D、向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ |
能用于工业生产的是( )
| A、钠在氯气中燃烧制氯化钠 |
| B、二氧化锰和浓盐酸共热制氯气 |
| C、氯气与消石灰反应制漂白粉 |
| D、电解NaCl溶液制金属钠 |
 按要求回答下列问题:
按要求回答下列问题: 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是