题目内容
11.按要求写出方程式.(1)碳酸钙和盐酸(写出离子方程式)CaCO3+2H+=CO2↑+H2O+Ca2+
(2)氢氧化钡溶液和稀硫酸(写出离子方程式)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(3)CO32-+2H+═CO2↑+H2O(写出对应的化学方程式)Na2CO3+2HCl=CO2↑+H2O+2NaCl
(4)H++OH-═H2O(写出对应的化学方程式)HCl+NaOH=NaCl+H2O.
分析 (1)碳酸钙和盐酸反应生成氯化钙、水、二氧化碳;
(2)氢氧化钡溶液和硫酸溶液发生复分解反应生成硫酸钡和水;
(3)CO32-+2H+=CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应;
(4)H++OH-═H2O该离子方程式可表示强酸与可溶性强碱溶液反应生成可溶性盐和水的反应.
解答 解:(1)盐酸的酸性强于碳酸,碳酸钙和盐酸反应生成氯化钙、水、二氧化碳,离子反应为CaCO3+2H+=CO2↑+H2O+Ca2+,
故答案为:CaCO3+2H+=CO2↑+H2O+Ca2+;
(2)氢氧化钡溶液和硫酸溶液反应生成硫酸钡和水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)CO32-+2H+=CO2↑+H2O 表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,如:Na2CO3+2HCl=CO2↑+H2O+2NaCl,
故答案为:Na2CO3+2HCl=CO2↑+H2O+2NaCl;
(4)H++OH-=H2O表示可溶性强碱与强酸反应生成可溶性盐和水的反应,如:HCl+NaOH=NaCl+H2O,
故答案为:HCl+NaOH=NaCl+H2O.
点评 本题考查了方程式的书写,题目难度不大,注意掌握离子方程式的概念、表示意义及书写原则,明确需要保留化学式的物质,如难溶物、弱电解质、氧化物,还要区别离子方程式满足守恒关系,如:质量守恒定律、电荷守恒、电子守恒.

练习册系列答案
相关题目
15.已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的$\frac{3}{5}$倍,下列叙述中正确的是( )
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所得电荷数SO42-是Na+的0.4倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
16.观察下列几个装置示意图,有关叙述不正确的是( )
| A. |  装置中阴极上析出红色固体 | |
| B. | 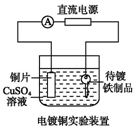 装置的待镀铁制品应与电源负极相连 | |
| C. | 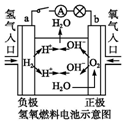 装置闭合电键后,外电路电子由a极流向b极 | |
| D. | 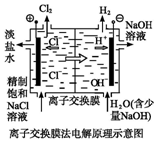 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
13.下列说法正确的是( )
| A. | 乙酸乙酯中是否混有乙酸,可以加石蕊试液进行检测 | |
| B. | 乙醇中是否混有乙酸,可以加入金属钠进行检验 | |
| C. | 乙酸乙酯、乙酸均能与NaOH反应,二者分子中的官能团相同 | |
| D. | 淀粉和蛋白质均可水解生成葡萄糖 |
6.在浓盐酸中HNO2与SnCl2反应的离子方程式为3SnCl2+12Cl-+2HNO2+6H+═N2+3SnClxy-+4H2O,关于该反应的说法都正确的是( )
①氧化剂是HNO2;②还原性:Cl->N2;③每生成2.8gN2,还原剂失去的电子为0.6mol;④x为6,y为2;⑤SnClx-是氧化产物.
①氧化剂是HNO2;②还原性:Cl->N2;③每生成2.8gN2,还原剂失去的电子为0.6mol;④x为6,y为2;⑤SnClx-是氧化产物.
| A. | ①③ | B. | ①③④⑤ | C. | ①②③④ | D. | ①④⑤ |
16.在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)?2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L•min).下列说法不正确的是( )
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)?2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(L•min).下列说法不正确的是( )
| A. | 反应4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K12/K2 | |
| B. | 平衡后c(Cl2)=2.5×10-2mol/L | |
| C. | 其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 | |
| D. | 平衡时NO2的转化率为50% |
3.资料显示“强酸性或强碱性溶液可使品红溶液褪色”.某兴趣小组探究S02使品红溶液褪色的原因,实验如下.
1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
(1)SO2水溶液中含$\stackrel{+4}{S}$的微粒有SO2、H2SO3、HSO3-、SO32-.
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
步骤一:
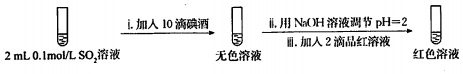
步骤二: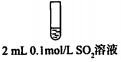
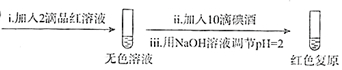
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).
1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
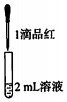 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
步骤一:

步骤二:

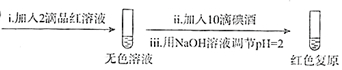
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).
8.下列各项描述与原电池原理的应用无关的是( )
| A. | 将△H<0的氧化还原反应设计成原电池,将化学能转变为电能 | |
| B. | 轮船水线以下的船壳上,嵌一定数量的锌块,保护船体不被腐蚀 | |
| C. | 在锌与稀硫酸反应的溶液中加入少量CuSO4,能加快生成H2的速率 | |
| D. | 为了保护地下钢管不受腐蚀,将它与一定电压的直流电源的负极相连 |