题目内容
3.资料显示“强酸性或强碱性溶液可使品红溶液褪色”.某兴趣小组探究S02使品红溶液褪色的原因,实验如下.1.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中.观察到前者褪色而后者不褪色.
实验二:
 | 试管中的溶液 | 现象 |
| a.0.1mol/LSO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
| b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
| c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
| d.pH=10NaOH溶液 | 红色溶液不变色 | |
| e.pH=2H2SO4溶液 | 红色溶液不变色 |
(2)NaHS03溶液显酸性的原因是HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度(用化学平衡原理解释).
(3)实验d的目的是证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰.
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是SO32-.
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变.
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红.
实验方案合理的是乙(选填“甲”或“乙”).结合离子方程式说明其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰.
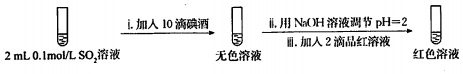
(6)丙同学利用SO2的还原性设计并完成了下列实验,得出结论:该褪色过程是可逆的.
步骤一:
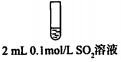
步骤二:
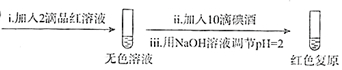
2.骤一,i中反应的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
②将步骤二中的实验方案补充完整(按步骤一的形式呈现).
分析 Ⅰ.(1)二氧化硫溶于水和水发生反应生成亚硫酸,亚硫酸存在两步电离;
(2)NaHS03溶液中存在亚硫酸氢钠电离和水解,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度;
(3)氢氧化钠溶液中红色不褪去说明氢氧根离子对品红褪色不干扰;
(4)a.0.1mol/LSO2溶液(pH=2),溶液逐渐变浅,约90s后完全褪色,
b.0.1mol/LNaHSO3溶液(pH=5),溶液立即变浅,约15s后完全褪色,
c.0.1mol/LNa2SO3溶液(pH=10),溶液立即褪色,说明亚硫酸根离子影响大;
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变,氢氧根离子不影响二氧化硫褪色,
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀亚硫酸钡,溶液变红,说明品红褪色可逆;
(6)依据步骤i设计步骤ii,先加入品红溶液褪色,滴入碘酒用氢氧化钠溶液调节溶液PH=2时,溶液恢复红色;
步骤一,i中反应是碘单质和二氧化硫在水溶液中发生反应生成碘化氢和硫酸.
解答 解:Ⅰ.(1)二氧化硫溶于水和水发生反应生成亚硫酸,亚硫酸存在两步电离,SO2+H2O?H2SO3,H2SO3?H++HSO3-,HSO3-?H++SO32-,SO2水溶液中含$\stackrel{+4}{S}$的微粒有:SO2、H2SO3、HSO3-、SO32-,
故答案为:SO2、H2SO3、HSO3-、SO32-,
(2)NaHS03溶液中,HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度,
故答案为:HSO3-离子存在平衡有电离平衡:HSO3-?H++SO32-,水解平衡:HSO3-+H2O?H2SO3+OH-,溶液显酸性说明亚硫酸氢根离子电离程度大于其水解程度;
(3)pH=10NaOH溶液中红色溶液不变色,证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰,
故答案为;证明该实验条件下氢氧根离子对品红溶液褪色不产生干扰;
(4)abc实验分析可知,a.0.1mol/LSO2溶液(pH=2),溶液逐渐变浅,约90s后完全褪色,
b.0.1mol/LNaHSO3溶液(pH=5),溶液立即变浅,约15s后完全褪色,
c.0.1mol/LNa2SO3溶液(pH=10),溶液立即褪色,
SO2使品红溶液褪色时起主要作用的微粒是SO32-,
故答案为:SO32-;
Ⅱ.探究褪色过程的可逆性
(5)甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变,氢氧根离子不影响二氧化硫褪色,不能说明二氧化硫的漂白性具有可逆性,
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀亚硫酸钡,溶液变红,说明品红褪色可逆;
实验方案合理的是乙,其原因是SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰,
故答案为:乙;SO32-能使品红褪色,因为SO2+2OH-+Ba2+=BaSO3↓+H2O,可以排除SO32-的干扰;
(6)步骤一,i中反应是碘单质和二氧化硫在水溶液中发生反应生成碘化氢和硫酸,反应的化学方程式为:SO2+I2+2H2O=2HI+H2SO4,
②依据步骤i设计步骤ii,先加入品红溶液褪色,滴入碘酒用氢氧化钠溶液调节溶液PH=2时,溶液恢复红色,步骤为:
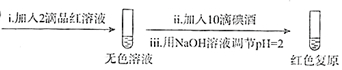 ,
,
故答案为:SO2+I2+2H2O=2HI+H2SO4;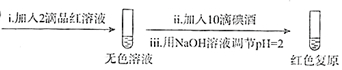 .
.
点评 本题考查了物质性质实验探究方法、实验设计、实验现象的理解应用,掌握基础是解题关键,题目难度中等.

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案| A. | 甲烷、乙烯和苯在工业上都可以通过石油分馏得到 | |
| B. | 苯和乙烯都可使溴的四氯化碳溶液褪色 | |
| C. | 甲烷、乙烯、乙醇都能发生氧化反应 | |
| D. | 汽油、柴油属于烃,植物油属于高分子化合物 |
| 叙述I | 叙述II |
| A.NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
| B.往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C.水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
| D.利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 油脂的皂化反应可得到高级脂肪酸与甘油 | |
| B. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 | |
| C. | 可以淀粉为原料制取乙酸乙酯 | |
| D. | 油脂的皂化反应属于加成反应 |
| A. | 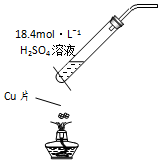 用图装置制取SO2 | |
| B. | 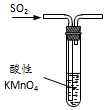 图装置中溶液的颜色变浅,说明SO2具有漂白性 | |
| C. | 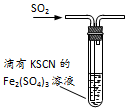 图装置中溶液的颜色变浅,说明SO2具有还原性 | |
| D. |  图装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性 |
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| C. | 金属冶炼过程是金属离子得电子变成金属单质的氧化过程 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
| A. | 1H、2H、3H互为同素异形体 | |
| B. | H2S分子中的化学键为非极性共价键 | |
| C. | S2-的结构示意图: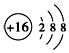 | |
| D. | NH4Cl的电子式: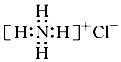 |