题目内容
16.观察下列几个装置示意图,有关叙述不正确的是( )| A. |  装置中阴极上析出红色固体 | |
| B. | 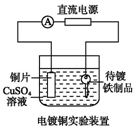 装置的待镀铁制品应与电源负极相连 | |
| C. | 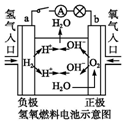 装置闭合电键后,外电路电子由a极流向b极 | |
| D. | 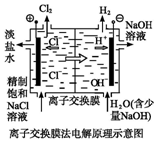 装置的离子交换膜允许阳离子、阴离子、水分子自由通过 |
分析 A.阳极上氯离子生成单质生成氯气,阴极铜离子得到电子生成铜;
B.电镀时,待镀铁制品作阴极,与电源负极相连;
C.外电路中电子从负极流向正极,通入氢气的一极为负极,通入氧气的电解为正极;
D.离子交换膜是阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过.
解答 解:A.装置中阳极上氯离子失去电子生成氯气,阴极铜离子得到电子生成铜,所以阴极上析出红色固体,故A正确;
B.在铁制品上镀铜时,阳极为铜,阴极为铁制品,所以铜片应该与电源的正极相连,待镀铁制品应与电源负极相连,故B正确;
C.装置中通入氧气的电解为正极,电子在外电路中从负极流向正极,即:a极→b极,故C正确;
D.阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过,避免阳极生成的氯气和阴极生成的氢氧根离子反应,故D错误;
故选D.
点评 本题考查了化学实验方案的评价,题目难度中等,明确原电池、电解池的工作原理为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
6.下列有关电解质溶液的叙述,不正确的是( )
| A. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH升高 | |
| B. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3 COO -) | |
| C. | 在氯水中通入氯化氢气体后,溶液中c(HClO)减小 | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
4.在一定条件下,反应:2NO+O2?NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是( )
| A. | 混合气体的总分子数不再变化 | B. | 混合气体的颜色不再变化 | ||
| C. | 容器的总压强不再变化 | D. | 混合气体的总质量不再变化 |
11.粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值.
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.
①写出硫酸溶液与Fe2O3反应的离子方程式6H++Fe2O3=2Fe3++3H2O.
②初步分离得到的滤渣主要成分是SiO2.
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合表分析其原因Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离.
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验.
①氨水使滤液中铝离子沉淀的离子方程式为3NH3•H2O+Al3+=Al(OH)3+3NH4+.
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是略小于5,选择该范围的理由是铝元素沉淀较多,铁元素还没有开始大量的沉淀.

Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3.
已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是冷却、结晶.
(2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整.
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.
①写出硫酸溶液与Fe2O3反应的离子方程式6H++Fe2O3=2Fe3++3H2O.
②初步分离得到的滤渣主要成分是SiO2.
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合表分析其原因Fe(OH)3和Al(OH)3沉淀的pH相近,不易通过沉淀分离.
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
①氨水使滤液中铝离子沉淀的离子方程式为3NH3•H2O+Al3+=Al(OH)3+3NH4+.
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是略小于5,选择该范围的理由是铝元素沉淀较多,铁元素还没有开始大量的沉淀.

Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3.
已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是冷却、结晶.
(2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整.
1.化学与生活生产密切相关,下列说法错误的是( )
| A. | 使用催化剂降低反应的活化能来提高化学反应效率 | |
| B. | 油脂和纤维素都属于高分子化合物 | |
| C. | 神州飞船的防护层中含聚四氯乙烯,合成它的单体属于卤代烃 | |
| D. | 中国古代利用明矾溶液的酸性清洗铜镜表面的铜锈 |
8.下列关于有机物的说法正确的是( )
| A. | 甲烷、乙烯和苯在工业上都可以通过石油分馏得到 | |
| B. | 苯和乙烯都可使溴的四氯化碳溶液褪色 | |
| C. | 甲烷、乙烯、乙醇都能发生氧化反应 | |
| D. | 汽油、柴油属于烃,植物油属于高分子化合物 |
12.化学与社会都密切相关,下列说法正确的是( )
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| C. | 金属冶炼过程是金属离子得电子变成金属单质的氧化过程 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |