题目内容
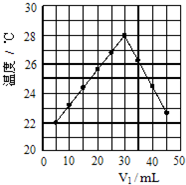 将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、由图可知进行该实验时环境温度约为22℃ |
| B、该实验表明1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量 |
| C、V1=30 mL时对应的中和热大于V1=10 mL时对应的中和热 |
| D、V1=10 mL时,混合后溶液的pH约为14 |
考点:酸碱混合时的定性判断及有关ph的计算,反应热和焓变
专题:化学反应中的能量变化,电离平衡与溶液的pH专题
分析:A.从图示观察起始温度即为实验时环境温度;
B.根据图示所测溶液温度变化判断反应物与生成物能量大小;
C.根据中和热的概念进行判断,中和热大小不受反应物、生成物的量的影响;
D、加入30mL盐酸时两溶液恰好反应,根据c酸V酸=c碱V碱进行计算氢氧化钠溶液的浓度,然后根据混合液中氢离子浓度计算溶液的pH.
B.根据图示所测溶液温度变化判断反应物与生成物能量大小;
C.根据中和热的概念进行判断,中和热大小不受反应物、生成物的量的影响;
D、加入30mL盐酸时两溶液恰好反应,根据c酸V酸=c碱V碱进行计算氢氧化钠溶液的浓度,然后根据混合液中氢离子浓度计算溶液的pH.
解答:
解:A.从图示观察起始温度即为实验时环境温度,因此该实验开始时温度是20℃,故A错误;
B.由图示可以看出该反应过程放出热量,表明反应物总能量大于生成物总能量,即:1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量,故B正确;
C、中和热指的是强酸和强碱的稀溶液发生中和反应生成1mol水释放的热量,所以中和热大小与反应物、生成物的量无关,故C错误;
D.恰好反应时参加反应的盐酸体积为30mL,则碱的体积为20mL,c(NaOH)=
=1.5mol/L,
V1=10mL时,氢氧化钠溶液体积为(50-10)mL=40mL,氢氧化钠过量,混合液显示碱性,混合液中氢氧根离子浓度为:c(OH-)=
=1mol/L,则此时溶液的pH=14,故D正确;
故选BD.
B.由图示可以看出该反应过程放出热量,表明反应物总能量大于生成物总能量,即:1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量,故B正确;
C、中和热指的是强酸和强碱的稀溶液发生中和反应生成1mol水释放的热量,所以中和热大小与反应物、生成物的量无关,故C错误;
D.恰好反应时参加反应的盐酸体积为30mL,则碱的体积为20mL,c(NaOH)=
| 0.03L×1.0mol/L |
| 0.02L |
V1=10mL时,氢氧化钠溶液体积为(50-10)mL=40mL,氢氧化钠过量,混合液显示碱性,混合液中氢氧根离子浓度为:c(OH-)=
| 1.5mol/L×0.04L-1mol/L×0.01L |
| 0.05L |
故选BD.
点评:本题考查中和反应、溶液pH的计算,题目难度中等,试题侧重学生图象及中和实质的考查,训练学生观察分析问题的能力,以及利用化学方程式计算的能力,比较综合.

练习册系列答案
相关题目
下列物质中,可用来鉴别乙酸溶液,葡萄糖溶液和淀粉溶液的是( )
| A、新制氢氧化铜悬浊液 | B、溴水 |
| C、稀盐酸 | D、碳酸钠溶液 |
在氧化还原反应KClO3+6HCl=KCl+3Cl2+3H2O中,当生成0.5mol Cl2时,氧化产物和还原产物的物质的量之比为( )
| A、5:1 | B、3:1 |
| C、1:3 | D、1:5 |
由乙醛和乙酸乙酯组成的混合物中,若含碳的质量分数为A%,则此混合物中含氢的质量分数为( )
| A、6A% | ||
B、
| ||
| C、10A% | ||
D、(100-
|
F2、Cl2、Br2、I2的氧化性递变规律依次为( )
| A、逐渐减弱 | B、逐渐增强 |
| C、变化不大 | D、无法比较 |
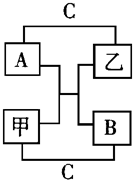 A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间存在如图所示的转化关系:若A为有色气体,C 为无色气体,B为淡黄色固体,请回答:
A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间存在如图所示的转化关系:若A为有色气体,C 为无色气体,B为淡黄色固体,请回答: