题目内容
由乙醛和乙酸乙酯组成的混合物中,若含碳的质量分数为A%,则此混合物中含氢的质量分数为( )
| A、6A% | ||
B、
| ||
| C、10A% | ||
D、(100-
|
考点:元素质量分数的计算
专题:计算题
分析:乙醛、甲酸甲酯组成的混合物中C、H两种元素的原子个数比都是1:2,故混合物中C、H两元素的质量之比=12:2=6:1,据此计算.
解答:
解:乙醛、甲酸甲酯组成的混合物中C、H两种元素的原子个数比都是1:2,故混合物C、H两元素的质量之比=12:2=6:1,若含碳的质量分数为A%,则混合物中H元素质量分数为A%×
=
%.
| 1 |
| 6 |
| A |
| 6 |
点评:本题考查混合物质量分数的有关计算,难度不大,关键是利用混合物中各成分的分子式得出C、H的固定组成.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
洗涤盛放过植物油的试管,宜选用的试剂是( )
| A、稀H2SO4 |
| B、热水 |
| C、热NaOH溶液 |
| D、浓HNO3 |
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A、稀硝酸 | B、稀盐酸 |
| C、硫酸铜溶液 | D、氢氧化钠溶液 |
下列化合物中,属于盐的是( )
| A、Al2O3 |
| B、CH3COOH |
| C、CaCl2 |
| D、NaOH |
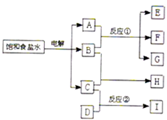 如图所示,每一方框中的字母各代表一种反应物或生成物:
如图所示,每一方框中的字母各代表一种反应物或生成物:物质A跟B反应生成物质E、F和G;物质C跟D在2L的反应容器中生成物质I,某温度下该反应起始时刻试剂的反应混合物组成如下表格所示,且D、I在常温下均为气体,
| C | D | I | |
| 起始组成/mol | 6 | 4 | 0 |
| 平衡组成/mol | 3 | 3 | 1 |
| A、物质H的化学式是HCl | ||
| B、反应①的化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O | ||
C、反应②的平衡常数等于
| ||
| D、电解饱和食盐水的阴极可以是铁棒,阳极可以是碳棒或铁棒 |
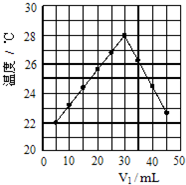 将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、由图可知进行该实验时环境温度约为22℃ |
| B、该实验表明1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量 |
| C、V1=30 mL时对应的中和热大于V1=10 mL时对应的中和热 |
| D、V1=10 mL时,混合后溶液的pH约为14 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1 mol?L-1甲酸溶液的pH约为2 |
| B、甲酸能与水以任意比例互溶 |
| C、10mL 1 mol?L-1甲酸恰好与10mL 1 mol?L-1NaOH溶液完全反应 |
| D、在相同条件下,甲酸溶液的导电性比醋酸溶液强 |
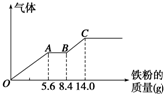 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )A、原混合酸中NO
| ||
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | ||
| C、第二份溶液中最终溶质为FeSO4 | ||
| D、H2SO4浓度为1.25 mol?L-1 |