题目内容
硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等.由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:
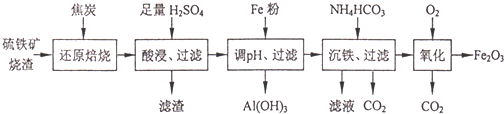
已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO.
几种离子开始沉淀和完全沉淀时的pH如下表所示:
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号) .
(2)Fe粉除调pH外,另一个作用是 ;Fe粉调节溶液的pH为 .
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为 ;所得滤液的主要溶质是(填化学式) .
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为 .

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO.
几种离子开始沉淀和完全沉淀时的pH如下表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
(2)Fe粉除调pH外,另一个作用是
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为
考点:制备实验方案的设计,难溶电解质的溶解平衡及沉淀转化的本质,铁的氧化物和氢氧化物
专题:几种重要的金属及其化合物
分析:硫铁矿烧渣与焦炭还原焙烧得到Fe2O3、Fe3O4、FeO、SiO2、Al2O3的混合物;混合物中加入足量硫酸,Fe2O3、Fe3O4、FeO、Al2O3与酸反应生成的硫酸亚铁、硫酸铁和硫酸铝;在滤液中加入铁粉调节PH值,铁粉具有还原性,可以将铁离子还原为亚铁离子,便于与铝离子的分离;将PH值调至4.7~7.6之间,使铝离子完全生成氢氧化铝沉淀;再加入碳酸氢铵,与亚铁离子反应生成碳酸亚铁沉淀,碳酸亚铁在高温下与氧气发生氧化还原反应生成氧化铁和二氧化碳,以此进行解答.
解答:
解:(1)Fe2O3、Fe3O4、FeO、Al2O3与酸反应生成的硫酸亚铁、硫酸铁和硫酸铝,故滤液中的金属阳离子有Fe2+、Fe3+、Al3+,
故答案为:Fe2+、Fe3+、Al3+;
(2)Fe3+与Al3+开始沉淀时的pH值相近,铁粉具有还原性,可以将铁离子还原为亚铁离子,便于与铝离子的分离;加入铁粉调节PH至4.7~7.6之间,使铝离子完全沉淀,而亚铁离子不沉淀,
故答案为:将铁离子还原为亚铁离子,便于与铝离子的分离;4.7~7.6之间;
(3)碳酸氢根离子与亚铁离子发生双水解反应生成碳酸亚铁沉淀、水和二氧化碳,离子方程式为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;所得滤液的主要溶质是硫酸铵,化学式为:(NH4)2SO4,
故答案为:(NH4)2SO4;
(4)碳酸亚铁与氧气发生氧化还原反应生成氧化铁和二氧化碳,方程式为:FeCO3+O2
2Fe2O3+CO2,故答案为:FeCO3+O2
2Fe2O3+CO2.
故答案为:Fe2+、Fe3+、Al3+;
(2)Fe3+与Al3+开始沉淀时的pH值相近,铁粉具有还原性,可以将铁离子还原为亚铁离子,便于与铝离子的分离;加入铁粉调节PH至4.7~7.6之间,使铝离子完全沉淀,而亚铁离子不沉淀,
故答案为:将铁离子还原为亚铁离子,便于与铝离子的分离;4.7~7.6之间;
(3)碳酸氢根离子与亚铁离子发生双水解反应生成碳酸亚铁沉淀、水和二氧化碳,离子方程式为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;所得滤液的主要溶质是硫酸铵,化学式为:(NH4)2SO4,
故答案为:(NH4)2SO4;
(4)碳酸亚铁与氧气发生氧化还原反应生成氧化铁和二氧化碳,方程式为:FeCO3+O2
| ||
| ||
点评:本题考查制备实验方案的设计与评价,难度较大.侧重学生分析能力和创新能力的培养.

练习册系列答案
相关题目
若NA代表阿伏加德罗常数的数值,则相对分子质量为a的一个分子的质量( )
| A、aNA g | ||
B、
| ||
C、
| ||
D、
|
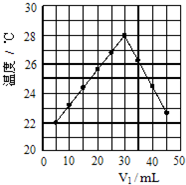 将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、由图可知进行该实验时环境温度约为22℃ |
| B、该实验表明1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量 |
| C、V1=30 mL时对应的中和热大于V1=10 mL时对应的中和热 |
| D、V1=10 mL时,混合后溶液的pH约为14 |
下列不是离子化合物的是( )
A、 |
B、 |
C、 |
D、 |
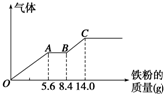 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )A、原混合酸中NO
| ||
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | ||
| C、第二份溶液中最终溶质为FeSO4 | ||
| D、H2SO4浓度为1.25 mol?L-1 |
关于下列各装置的叙述中,错误的是( )
A、 可用于探究NH4HCO3的热稳定性 |
B、 可用于收集H2、CO2 |
C、 X若为CCl4,可用于吸收氨气或氯化氢,并能防倒吸 |
D、 可用于干燥、收集NH3,并吸收多余的氨气 |
 )的废水可以通过构成微生物电池除去,其原理如图1所示.
)的废水可以通过构成微生物电池除去,其原理如图1所示.