题目内容
在氧化还原反应KClO3+6HCl=KCl+3Cl2+3H2O中,当生成0.5mol Cl2时,氧化产物和还原产物的物质的量之比为( )
| A、5:1 | B、3:1 |
| C、1:3 | D、1:5 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:KClO3+6HCl=KCl+3Cl2+3H2O中,氯酸钾中Cl元素的化合价降低,为氧化剂,而HCl中Cl元素的化合价升高,为还原剂,以此来解答.
解答:
解:KClO3+6HCl=KCl+3Cl2+3H2O中,氯酸钾中Cl元素的化合价降低,为氧化剂,而HCl中Cl元素的化合价升高,为还原剂,由反应可知1mol氧化剂与5mol还原剂(HCl)转移电子守恒,氧化剂对应还原产物,还原剂对应氧化产物,氧化产物、还原产物均为氯气,由原子守恒可知,氧化产物和还原产物的物质的量之比为5:1,
故选A.
故选A.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子守恒、原子守恒为解答的关键,侧重守恒法及分析能力的考查,注意不需要利用0.5mol Cl2计算,题目难度不大.

练习册系列答案
相关题目
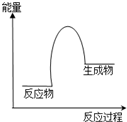 根据如图提供的信息,不能够得到的结论是( )
根据如图提供的信息,不能够得到的结论是( )| A、该反应一定有能量转化成了生成物的化学能 |
| B、该反应中化学能转化成了热能,为放热反应 |
| C、该反应生成物的总能量高于反应物的总能量 |
| D、该反应过程中有比生成物能量更高的中间物质生成 |
若NA代表阿伏加德罗常数的数值,则相对分子质量为a的一个分子的质量( )
| A、aNA g | ||
B、
| ||
C、
| ||
D、
|
将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A、稀硝酸 | B、稀盐酸 |
| C、硫酸铜溶液 | D、氢氧化钠溶液 |
对于10%H2O2的分解反应,下列措施能减缓其化学反应速率的是( )
| A、加入MnO2 |
| B、加水稀释 |
| C、加热 |
| D、加入30%的H2O2 |
下列化合物中,属于盐的是( )
| A、Al2O3 |
| B、CH3COOH |
| C、CaCl2 |
| D、NaOH |
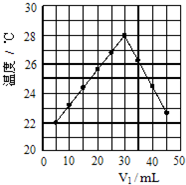 将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、由图可知进行该实验时环境温度约为22℃ |
| B、该实验表明1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量 |
| C、V1=30 mL时对应的中和热大于V1=10 mL时对应的中和热 |
| D、V1=10 mL时,混合后溶液的pH约为14 |
关于下列各装置的叙述中,错误的是( )
A、 可用于探究NH4HCO3的热稳定性 |
B、 可用于收集H2、CO2 |
C、 X若为CCl4,可用于吸收氨气或氯化氢,并能防倒吸 |
D、 可用于干燥、收集NH3,并吸收多余的氨气 |