题目内容
HN3叠氮酸中N的化合价(氧化态)为多少?
(1)请写出,酸性条件下,N2H5+和HNO2制备HN3反应的方程式并标示出反应中N化合价(氧化态)的改变;碱性介质中,N2H5OH和NCl3生成N3-反应的方程式.
(2)请写出HClO和HN3生成N2反应的方程式.并写出HNO2和HN3反应(物质的量比为1:1),生成三种产物,其中一种是H2O的反应方程式. .
(1)请写出,酸性条件下,N2H5+和HNO2制备HN3反应的方程式并标示出反应中N化合价(氧化态)的改变;碱性介质中,N2H5OH和NCl3生成N3-反应的方程式.
(2)请写出HClO和HN3生成N2反应的方程式.并写出HNO2和HN3反应(物质的量比为1:1),生成三种产物,其中一种是H2O的反应方程式.
考点:氮族元素简介,氯、溴、碘及其化合物的综合应用
专题:元素及其化合物
分析:正负化合价代数和为0;
(1)亚硝酸中氮元素由+3降低到-
,N2H5+中氮元素由-2升高到-
;N2H5OH和NCl3生成N3-和氯离子;
(2)HClO和HN3生成N2和氯离子;HNO2和HN3反应生成氮气、一氧化二氮和水.
(1)亚硝酸中氮元素由+3降低到-
| 1 |
| 3 |
| 1 |
| 3 |
(2)HClO和HN3生成N2和氯离子;HNO2和HN3反应生成氮气、一氧化二氮和水.
解答:
解:正负化合价代数和为0,氢为+1价,HN3叠氮酸中N的化合价为-
,故答案为:-
;
(1)亚硝酸中氮元素由+3降低到-
,N2H5+中氮元素由-2升高到-
,方程式 ;碱性介质中,N2H5OH和NCl3生成N3-反应的方程式N2H5OH+NCl3+4OH-=N3-+3Cl-+5H2O,
;碱性介质中,N2H5OH和NCl3生成N3-反应的方程式N2H5OH+NCl3+4OH-=N3-+3Cl-+5H2O,
故答案为: ;N2H5OH+NCl3+4OH-=N3-+3Cl-+5H2O;
;N2H5OH+NCl3+4OH-=N3-+3Cl-+5H2O;
(2)HClO和HN3生成N2和氯离子:2HN3+HClO=3N2+Cl-+H2O;HNO2和HN3反应生成氮气、一氧化二氮和水:HN3+HNO2=N2+N2O+H2O,
故答案为:2HN3+HClO=3N2+Cl-+H2O;HN3+HNO2=N2+N2O+H2O.
| 1 |
| 3 |
| 1 |
| 3 |
(1)亚硝酸中氮元素由+3降低到-
| 1 |
| 3 |
| 1 |
| 3 |
 ;碱性介质中,N2H5OH和NCl3生成N3-反应的方程式N2H5OH+NCl3+4OH-=N3-+3Cl-+5H2O,
;碱性介质中,N2H5OH和NCl3生成N3-反应的方程式N2H5OH+NCl3+4OH-=N3-+3Cl-+5H2O,故答案为:
 ;N2H5OH+NCl3+4OH-=N3-+3Cl-+5H2O;
;N2H5OH+NCl3+4OH-=N3-+3Cl-+5H2O;(2)HClO和HN3生成N2和氯离子:2HN3+HClO=3N2+Cl-+H2O;HNO2和HN3反应生成氮气、一氧化二氮和水:HN3+HNO2=N2+N2O+H2O,
故答案为:2HN3+HClO=3N2+Cl-+H2O;HN3+HNO2=N2+N2O+H2O.
点评:本题考查氧化还原反应和化学方程式的书写,注意发生的氧化还原反应为解答的难点,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
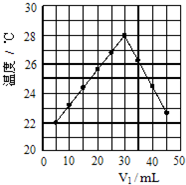 将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、由图可知进行该实验时环境温度约为22℃ |
| B、该实验表明1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量 |
| C、V1=30 mL时对应的中和热大于V1=10 mL时对应的中和热 |
| D、V1=10 mL时,混合后溶液的pH约为14 |
关于下列各装置的叙述中,错误的是( )
A、 可用于探究NH4HCO3的热稳定性 |
B、 可用于收集H2、CO2 |
C、 X若为CCl4,可用于吸收氨气或氯化氢,并能防倒吸 |
D、 可用于干燥、收集NH3,并吸收多余的氨气 |
用二氧化锰作催化剂分解氯酸钾制得的氧气,往往具有特殊的异味,这种气体通过KI-淀粉溶液时,溶液变蓝.氧气中可能混有( )
| A、Cl2 |
| B、N2 |
| C、Br2 |
| D、F2 |
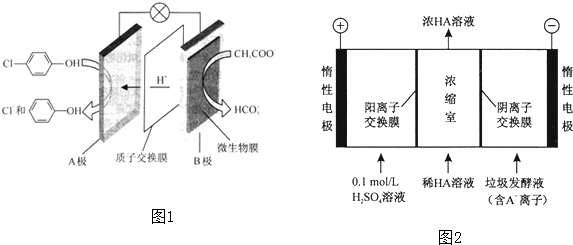
 )的废水可以通过构成微生物电池除去,其原理如图1所示.
)的废水可以通过构成微生物电池除去,其原理如图1所示.
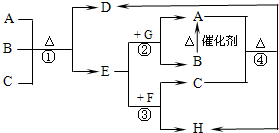 如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.
如图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体.