题目内容
明矾溶液pH 7((填“>”、“<”或“=”),原因是: .明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH 7(填“>”、“<”或“=”),其原因是 ,(用离子方程式表示).所得沉淀溶解平衡的表示式为: .
考点:盐类水解的应用,以氯碱工业为基础的化工生产简介
专题:盐类的水解专题
分析:明矾中铝离子水解导致溶液呈酸性,明矾和Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,明矾和氢氧化钡以1:2反应,二者还生成偏铝酸钾,偏铝酸根离子水解导致溶液呈碱性;硫酸钡在水溶液里存在溶解平衡,生成钡离子和硫酸根离子.
解答:
解:明矾中铝离子水解导致溶液呈酸性,所以溶液的pH<7,明矾和Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,明矾和氢氧化钡以1:2反应,二者还生成偏铝酸钾,离子方程式为Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,偏铝酸根离子水解导致溶液呈碱性,水解方程式为AlO2-+2 H2O?Al(OH)3+OH-;硫酸钡在水溶液里存在溶解平衡,生成钡离子和硫酸根离子,电离方程式为BaSO4(s)?Ba2+(aq)+SO42-(aq),
故答案为:<;Al3++3H2O?Al(OH)3+3H+;>;Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O、AlO2-+2 H2O?Al(OH)3+OH-;BaSO4(s)?Ba2+(aq)+SO42-(aq).
故答案为:<;Al3++3H2O?Al(OH)3+3H+;>;Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O、AlO2-+2 H2O?Al(OH)3+OH-;BaSO4(s)?Ba2+(aq)+SO42-(aq).
点评:本题考查盐类水解,根据形成盐的酸和碱相对强弱确定溶液酸碱性,注意多元弱酸、多元弱碱离子水解方程式书写区别,为易错点.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、SO3的水溶液能导电,所以SO3是电解质 |
| B、氯化钠晶体不导电,但是氯化钠是电解质 |
| C、氯化钠溶液能导电,所以氯化钠溶液是电解质 |
| D、液态氯化氢不能导电,但是氯化氢是电解质 |
对于10%H2O2的分解反应,下列措施能减缓其化学反应速率的是( )
| A、加入MnO2 |
| B、加水稀释 |
| C、加热 |
| D、加入30%的H2O2 |
在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A、v(NH3)=0.3mol/(L?min) |
| B、v (N2)=0.2 mol/(L?min) |
| C、v (N2)=0.01mol/(L?s) |
| D、v (H2)=0.3 mol/(L?min) |
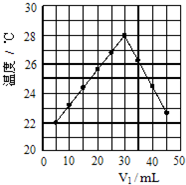 将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、由图可知进行该实验时环境温度约为22℃ |
| B、该实验表明1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量 |
| C、V1=30 mL时对应的中和热大于V1=10 mL时对应的中和热 |
| D、V1=10 mL时,混合后溶液的pH约为14 |
光纤通讯是一种现代化的通讯手段,光导纤维的成分是( )
| A、Na2SiO3 |
| B、Si |
| C、SiO2 |
| D、CaCO3 |
下列不是离子化合物的是( )
A、 |
B、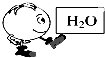 |
C、 |
D、 |
