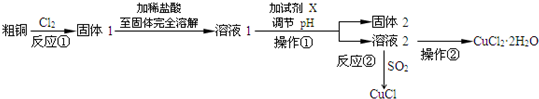
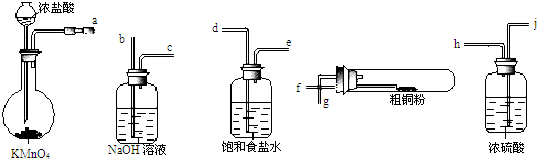
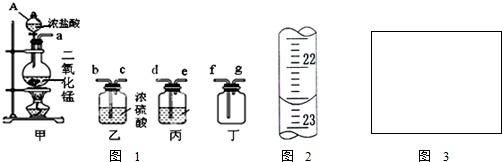
题目内容
下列说法正确的是( )
| A、常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B、在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小 |
| C、0.lmoI.L-lNH4Cl溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:c (Cl-)>c (NH4+)>c (Na+)>c (OH-) |
| D、a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一定小于6 |
考点:弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:A、醋酸钠溶液显碱性,存在醋酸分子;
B、NaOH能够抑制亚硫酸根离子的水解;
C、混合溶液的组成为等物质的量浓度氯化铵、氯化钠和一水合氨的混合溶液;
D、据电荷守恒解答.
B、NaOH能够抑制亚硫酸根离子的水解;
C、混合溶液的组成为等物质的量浓度氯化铵、氯化钠和一水合氨的混合溶液;
D、据电荷守恒解答.
解答:
解:A、因为醋酸根的水解,醋酸钠溶液显碱性,存在醋酸分子,故A错误;
B、NaOH能够抑制亚硫酸根离子的水解,Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)增大,故B错误;
C、混合溶液的组成为等物质的量浓度的氯化铵、氯化钠和一水合氨的混合溶液,一水合氨的电离程度大于铵根离子的水解程度,c (NH4+)>c (Na+),离子浓度的大小顺序为:c (Cl-)>c (NH4+)>c (Na+)>c(OH-)>c (H+),故C正确;
D、HCN溶液与NaOH溶液的混合溶液中,依据电荷守恒,c(Na+)>c(CN-)则c(OH-)>c(H+),溶液显碱性,a=6时,HCN与NaOH恰好反应得到NaCN溶液,NaCN是强碱弱酸盐,水解导致溶液显碱性,所以a不一定小于6,故D错误;
故选C.
B、NaOH能够抑制亚硫酸根离子的水解,Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)增大,故B错误;
C、混合溶液的组成为等物质的量浓度的氯化铵、氯化钠和一水合氨的混合溶液,一水合氨的电离程度大于铵根离子的水解程度,c (NH4+)>c (Na+),离子浓度的大小顺序为:c (Cl-)>c (NH4+)>c (Na+)>c(OH-)>c (H+),故C正确;
D、HCN溶液与NaOH溶液的混合溶液中,依据电荷守恒,c(Na+)>c(CN-)则c(OH-)>c(H+),溶液显碱性,a=6时,HCN与NaOH恰好反应得到NaCN溶液,NaCN是强碱弱酸盐,水解导致溶液显碱性,所以a不一定小于6,故D错误;
故选C.
点评:本题考查了盐类水解、离子浓度大小比较和电荷守恒,题目难度中等.

练习册系列答案
相关题目
X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
| A、X2YZ3 |
| B、X2YZ2 |
| C、X3YZ3 |
| D、XYZ3 |
我国的PM2.5大气环境质量标准即将出台.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.PM2.5粒径小,富含大量的有毒、有害物质且在大气中停留时间长,因而对人体健康和大气环境质量影响更大.下列有关说法不正确的是( )
| A、灰霾主要由PM2.5组成 |
| B、PM2.5颗粒直径小,表面积大,吸附能力强,吸附有毒物会增强它的毒性 |
| C、目前我国空气污染指数(API)指标数值范围只包含二氧化硫(SO2)、二氧化氮(NO2)和可吸入颗粒物(PM10)三个指标 |
| D、PM10为可吸入性颗粒,将其纳入空气污染指数(API),是因为其危害比PM2.5更大 |
短周期元素W、X、Y和Z的原子序数依次增大.其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3.根据以上叙述,下列说法中正确的是( )
| A、以上四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
下列说法正确的是( )
| A、浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 |
| B、若R的含氧酸的酸性强于Q的含氧酸的酸性,则非金属性R强于Q |
| C、碳、钠与O2反应时,由于O2的量不同,可分别生成CO、CO2和Na2O、Na2O2 |
| D、所有的酸酐都是氧化物 |

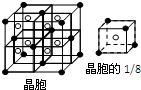 A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:
A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题: