题目内容
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A、若有l mol NO3-参加还原反应,则转移8mol e- |
| B、还原产物为NH4+ |
| C、氧化剂与还原剂的物质的量之比为8:l |
| D、若把该反应设计为原电池,则负极反应为Fe 2+-e-=Fe 3+ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:Fe2+具有还原性,NO3-在酸性条件下具有强氧化性,由题意可以确定,铁元素的化合价升高,N元素的化合价降低,则发生反应8Fe2++NO3-+10H+=8Fe3++NH4++H2O,
A.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,据此计算有lmolNO3- 发生还原反应,转移电子数;
B.氧化剂通过还原反应生成的产物为还原产物.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价;
C.该反应中氧化剂是NO3-,还原剂是Fe2+,结合方程式判断氧化剂与还原剂的物质的量之比;
D.原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+.
A.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,据此计算有lmolNO3- 发生还原反应,转移电子数;
B.氧化剂通过还原反应生成的产物为还原产物.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价;
C.该反应中氧化剂是NO3-,还原剂是Fe2+,结合方程式判断氧化剂与还原剂的物质的量之比;
D.原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+.
解答:
解:Fe2+具有还原性,NO3-在酸性条件下具有强氧化性,由题意可以确定,铁元素的化合价升高,N元素的化合价降低,则发生反应8Fe2++NO3-+10H+=8Fe3++NH4++H2O.
A.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,所以有lmolNO3- 发生还原反应,转移电子数为1mol×[5-(-3)]=8mol,故A正确;
B.氧化剂通过还原反应生成的产物为还原产物.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,NH4+是还原产物,故B正确;
C.由方程式可知该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8,故C错误;
D.原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+,若把该反应设计成原电池,负极反应为Fe2+-e-=Fe3+,故D正确.
故选C.
A.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,所以有lmolNO3- 发生还原反应,转移电子数为1mol×[5-(-3)]=8mol,故A正确;
B.氧化剂通过还原反应生成的产物为还原产物.反应中N元素的化合价由NO3-中+5价降低为NH4+中-3价,NH4+是还原产物,故B正确;
C.由方程式可知该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8,故C错误;
D.原电池负极发生氧化反应,Fe2+在负极放电生成Fe3+,若把该反应设计成原电池,负极反应为Fe2+-e-=Fe3+,故D正确.
故选C.
点评:本题考查氧化还原反应、原电池等,为高考常见题型,侧重于学生的计算能力和分析能力的考查,难度中等,根据反应物和生成物结合物质的性质书写该反应的离子方程式是解答关键.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
下列说法正确的是( )
| A、金刚石与60C互为同位素 |
| B、碳酸氢钠的热稳定性比碳酸钠的强 |
| C、能够使澄清的石灰水变浑浊的气体一定是CO2 |
| D、碳酸钠溶液和碳酸氢钠溶液都能与澄清的石灰水反应生成沉淀 |
下列说法正确的是( )
A、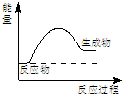 如图所示的是一个放热反应 |
| B、加入催化剂v(正)增大、v(逆)减小 |
| C、吸热反应只能在加热的条件下才能进行 |
| D、只有活化分子才能发生有效碰撞 |
把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
| A、盐酸的浓度 |
| B、铝条的表面积 |
| C、溶液的温度 |
| D、加少量Na2SO4 |
“信息”、“材料”和“能源”被称为新科技革命的三大支柱.下列有关资讯错误的是( )
| A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B、目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C、2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料 |
| D、合成高分子材料的广泛应用是有百利而无一害 |
X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
| A、X2YZ3 |
| B、X2YZ2 |
| C、X3YZ3 |
| D、XYZ3 |
不能区别三氯化铁溶液和氢氧化铁胶体的方法有( )
| A、观察颜色 |
| B、丁达尔效应 |
| C、滴加浓的氯化钠溶液 |
| D、过滤实验 |