题目内容
下列事实中,不能用勒夏特列原理解释的是( )
| A、盛有NO2和N2O4 混合气体的烧瓶置于热水中,气体颜色变深 |
| B、工业合成氨选择500℃左右的温度比室温有利 |
| C、实验室中常用排饱和食盐水的方法收集Cl2 |
| D、合成氨时采用循环操作及将氨液化分离,可提高原料的利用率 |
考点:化学平衡移动原理
专题:化学平衡专题
分析:勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关,则不能用勒夏特利原理解释.
解答:
解:A、2NO2?N2O4,△H<0,混合气体的烧瓶置于热水中,升温,平衡逆向移动,颜色加深,能用平衡移动原理解释,故A不选;
B、工业合成氨的反应是可逆的,选择500℃左右的较高温度能使反应逆向进行,不利于化学平衡的正向移动,使用该温度主要是考虑催化剂的催化效率以及反应速率等知识,所以不能用化学平衡移动原理解释,故B选;
C、氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用化学平衡移动原理解释,故C不选;
D、N2+3H2?2NH3,将氨液化分离,减小生成物浓度,平衡正向移动,氮气和氢气的转化率变大,故能用勒夏特列原理解释,故D不选;
故选B.
B、工业合成氨的反应是可逆的,选择500℃左右的较高温度能使反应逆向进行,不利于化学平衡的正向移动,使用该温度主要是考虑催化剂的催化效率以及反应速率等知识,所以不能用化学平衡移动原理解释,故B选;
C、氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用化学平衡移动原理解释,故C不选;
D、N2+3H2?2NH3,将氨液化分离,减小生成物浓度,平衡正向移动,氮气和氢气的转化率变大,故能用勒夏特列原理解释,故D不选;
故选B.
点评:本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 |
| B、若R的含氧酸的酸性强于Q的含氧酸的酸性,则非金属性R强于Q |
| C、碳、钠与O2反应时,由于O2的量不同,可分别生成CO、CO2和Na2O、Na2O2 |
| D、所有的酸酐都是氧化物 |
常温条件下,下列溶液中的各组离子一定能够大量共存的是( )
| A、pH=1的溶液:Na+、Fe2+、Cl-、NO3- | ||
| B、含有大量I-的溶液:ClO-、Na+、Cl-、CO32- | ||
C、
| ||
| D、加入铝粉能放出大量H2的溶液:K+、NH4+、SO42-、CO32- |
下列实验事实不能说明醋酸是弱电解质的是( )
| A、醋酸溶液的导电性比盐酸弱 |
| B、0.01ml/L醋酸溶液PH>2 |
| C、CH3COONa溶液PH>7 |
| D、将PH=3醋酸溶液稀释100倍,稀释后溶液PH:3<PH<5 |
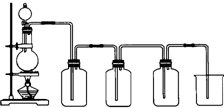 已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.
已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:即当足量Cl2与铁反应时则生成FeCl3,当少量Cl2与足量铁反应时则生成FeCl2.为验证该观点是否正确,该同学设计了以下实验.